DIFERENCIACIÓN DE LAS SUSTANCIAS DE ACUERDO CON SU PH
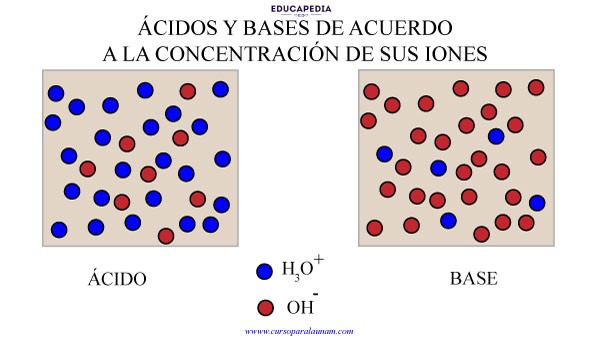
La acidez o basicidad de una disolución acuosa se mide por medio de la concentración relativa del H3O+ y del OH–.
En soluciones acidas, la concentración de iones H3O+ es mayor que la concentración de iones OH-.
O también podemos decir que en las soluciones acidas:
1.- La concentración de iones H3O+ es mayor a 1 x 10-7 M
2.- La concentración de iones OH- es menor a 1 x 10-7 M
Y a la inversa, podemos decir que en las soluciones básicas:
1.- La concentración de iones H3O+ es menor a 1 x 10-7 M
2.- La concentración de iones OH- es mayor a 1 x 10-7 M
Debido a que estas concentraciones pueden abarcar un amplio rango de valores, la acidez o basicidad de una disolución se miden en una escala logarítmica.
Además, podemos medir la concentración de ion H3O+ (pH) o la concentración del ion OH– (llamado pOH).
DEFINICIÓN DE PH
El pH se define como el logaritmo negativo (base 10) de la concentración de iones hidronio (H3O+).
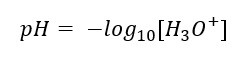
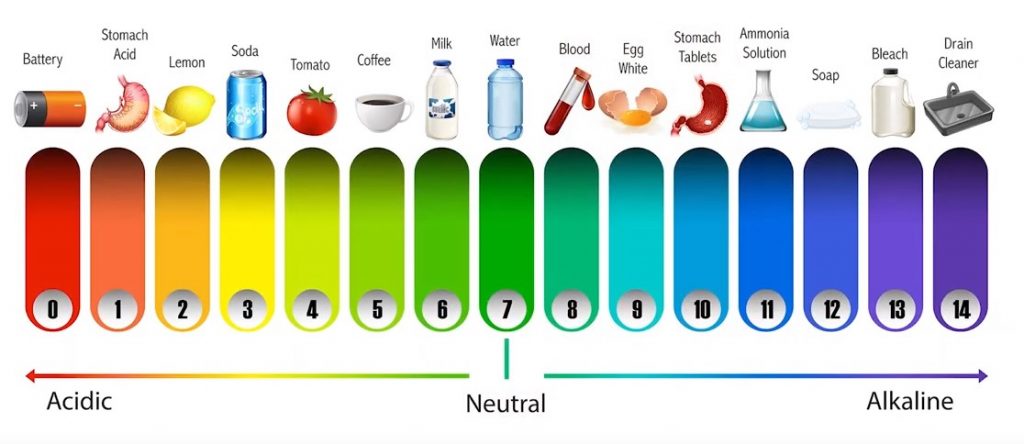
Una disolución neutra tiene un pH de 7, una disolución acida tiene un pH menor a 7 y una disolución básica tiene un pH mayor a 7.
¡Ojo!
Fíjate bien que entre más acida una sustancia, tiene más iones hidronio (H3O+). Pero el pH, como se tomó el logaritmo negativo, invierte el sentido.
Entre más acida es una sustancia más pequeño es su pH.
Entre más básica o alcalina es una sustancia más grande es su pH, o menos concentración de iones hidronio tiene.
Ejemplos:
Sin mirar la imagen anterior:
1.- Determina si el jugo de naranja tiene un pH menor o mayor a 7.
Mas ejemplos, ejercicios y preguntas clave de examen, en nuestras guías digitales.
-
 Guía UNAM Área 4 2023Producto rebajado$450.00
Guía UNAM Área 4 2023Producto rebajado$450.00 -
 Guía UNAM Área 3 2023Producto rebajado$450.00
Guía UNAM Área 3 2023Producto rebajado$450.00 -
 Guía UNAM Área 2 2023Producto rebajado$450.00
Guía UNAM Área 2 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 4-2023$80.00
Guía UNAM de Química Área 4-2023$80.00 -
 Guía UNAM de Química Área 3-2023$80.00
Guía UNAM de Química Área 3-2023$80.00 -
 Guía UNAM de Química Área 2-2023$90.00
Guía UNAM de Química Área 2-2023$90.00 -
 Guía UNAM Área 1 2023Producto rebajado$450.00
Guía UNAM Área 1 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 1-2023$80.00
Guía UNAM de Química Área 1-2023$80.00





