CONCENTRACIÓN: MOLARIDAD Y PORCENTUAL
CONCENTRACIÓN
La concentración de un soluto es la cantidad de este soluto presente en una cantidad de disolvente.
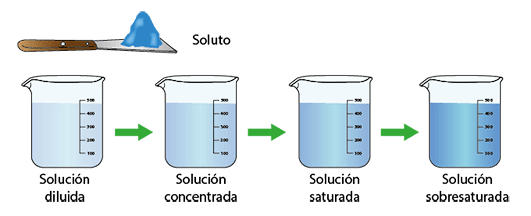
Para medir la concentración de un soluto tenemos dos formas:
1.- El porcentual
2.- La molaridad
EL PORCENTUAL
El porcentual es la relación porcentual entre dos tipos de unidades; las masas del soluto y el disolvente y los volúmenes del soluto y el disolvente.
EL PORCENTAJE EN MASA O PESO PORCENTUAL
El porcentaje en masa (también llamado porcentaje masa en masa o peso en peso) es la división de la masa de un soluto entre la masa de la disolución, multiplicado por 100.

Ejemplos:
Una muestra de .892 g de cloruro de potasio (KCl) se disuelve en 54.6 g de agua ¿Cuál es el porcentual del KCl?

EL PORCENTAJE EN VOLUMEN
El porcentaje en volumen es la división del volumen de un soluto entre el volumen de la disolución, multiplicado por 100.

Ejemplo:
Determina el volumen total de una lata de cerveza de 50 y 17.25 ml de alcohol etílico. (recuerda que 50 significa 5%v/v)
Despejando el volumen de la disolución en nuestra ecuación tenemos:

LA MOLARIDAD
La molaridad es el número de moles de un soluto en 1 litro de disolución.

Ejemplos:
1.- Determina la molaridad de una disolución de 20g de NaCl en 180ml de agua. Las masas atómicas de Na = 23 y de Cl = 35.5.
Primero debemos calcular cuántos mol tiene 20g de NaCl.
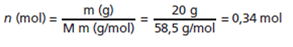
Después determinamos la concentración de la disolución.

Mas ejemplos, ejercicios y preguntas clave de examen, en nuestras guías digitales.
-
 Guía UNAM Área 4 2023Producto rebajado$450.00
Guía UNAM Área 4 2023Producto rebajado$450.00 -
 Guía UNAM Área 3 2023Producto rebajado$450.00
Guía UNAM Área 3 2023Producto rebajado$450.00 -
 Guía UNAM Área 2 2023Producto rebajado$450.00
Guía UNAM Área 2 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 4-2023$80.00
Guía UNAM de Química Área 4-2023$80.00 -
 Guía UNAM de Química Área 3-2023$80.00
Guía UNAM de Química Área 3-2023$80.00 -
 Guía UNAM de Química Área 2-2023$90.00
Guía UNAM de Química Área 2-2023$90.00 -
 Guía UNAM Área 1 2023Producto rebajado$450.00
Guía UNAM Área 1 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 1-2023$80.00
Guía UNAM de Química Área 1-2023$80.00



