ALCOHOL, ÉTER, ALDEHÍDO, CETONA, ÁCIDOS CARBOXÍLICOS, ESTER, ANIMAS, AMIDAS Y COMPUESTOS HALOGENADOS
ALCOHOLES
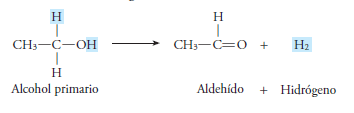
Lo alcoholes se forman cuando se sustituye en los hidrocarburos uno o más átomos de hidrogeno por uno o más grupos hidroxilo (OH).
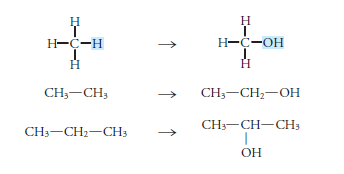
Y su representación es R-OH
Cuando solo es sustituido un átomo de hidrogeno por un radical hidroxilo (-OH), los alcoholes pueden ser primarios, secundarios o terciarios, según sea el átomo de carbono donde ocurra la sustitución.
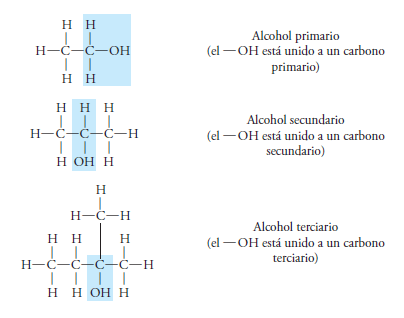
Los alcoholes también se clasifican en mono alcoholes (alcoholes monovalentes) o polialcoholes (alcoholes polivalentes) (di alcoholes, tri alcoholes, etc.) según contengan en su molécula uno o más grupos –OH
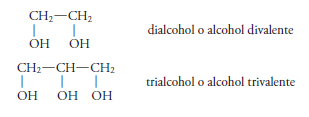
ÉTERES
Los éteres se forman cuando 2 radicales alquilo se unen mediante un átomo de oxígeno (R-O-R). También cuando se sustituye el hidrogeno del grupo OH de los alcoholes por un radical alquilo.

O cuando dos moléculas de alcoholes reaccionan entre sí, eliminando una molécula de agua.

Su grupo funcional es: R1 – O – R2, donde R1 y R2 son radicales alquilo y su estructura electrónica es:
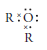
Si los radicales alquilo son iguales, se les llama éteres simples, si son diferentes se les llama éteres mixtos.
ALDEHÍDOS
Tanto los aldehídos como las cetonas contienen un grupo funcional llamado “Carbonilo” (CO), que es uno de los grupos más importantes en química orgánica y bioquímica.
Aldehído significa “alcohol deshidrogenado”, ya que se les considera como productos de la oxidación parcial de alcoholes primarios.
“Los aldehídos se forman cuando en el grupo funcional de los alcoholes primarios (-CH2-OH) se eliminan 2 átomos de hidrogeno”.
El grupo funcional de los aldehídos es:
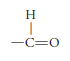
y su representación es R-CHO.
La estructura electrónica de Lewis de los aldehídos, si se sabe que R es monovalente es:
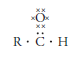
Y en forma desarrollada es:
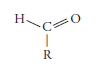
PROPIEDADES DE LOS ALDEHÍDOS
Los aldehídos que tienen hasta 4 átomos de carbono en su molécula, son totalmente solubles en agua. Esta solubilidad decrece conforme aumenta el número de carbono. A partir de 7 carbonos ya no son solubles en agua.
También de forma general los aldehídos son menos densos que el agua. El metanal es gaseoso, pero a partir del etanal son líquidos y se empiezan a solidificar conforme crece el número de carbonos en su molécula.
En la vida cotidiana, el metanal comúnmente conocido como formaldehido, en solución acuosa forma el formol que se emplea como germicida y en la conservación de muestras anatómicas.
El benzaldehído es el aldehído del benceno, que se utiliza en perfumería, en productos farmacéuticos y en colorantes.
CETONAS
Como recordaras, en los aldehídos, el grupo carbonilo (CO), está unido a un átomo de Hidrógeno y a un radical alquilo. En este caso de las cetonas, el grupo carbonilo se une a dos radicales alquilo.
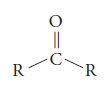
Las cetonas son compuestos que resultan de la oxidación de alcoholes secundarios.
Se forman cuando el grupo funcional de los alcoholes secundarios (CH-OH) pierde 2 átomos de hidrogeno.
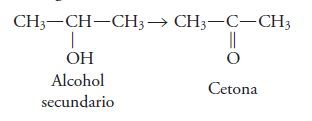
El grupo funcional de las cetonas es:
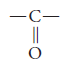
y se llama carbonilo.
La representación general de las cetonas es R – CO – R.
La estructura de Lewis de las cetonas se representa así:
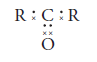
Y su forma desarrollada es:
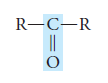
PROPIEDADES DE LAS CETONAS
En general son liquidas, pero a partir de los 16 átomos de carbono son sólidas. Tienen un olor agradable, son solubles en alcohol, éter y cloroformo.
El uso más importante en la vida diaria es la propanona, o acetona común. Se utiliza para diluir gran cantidad de compuestos orgánicos, por ello forma parte de diluyente de pintura y removedor del esmalte para uñas.
COMPUESTOS HALOGENADOS
Los compuestos o derivados halogenados se obtienen al sustituir uno o más hidrógenos de la cadena, por uno o más halógenos. Por lo tanto, solo contienen Carbono, Hidrogeno y alguno de los halógenos (flúor, cloro, bromo y yodo).
Estos compuestos se obtienen mediante un tipo de reacción llamada “reacción por sustitución”, donde un átomo o un grupo de ellos sustituye a otro. Cuanto el átomo que va a sustituir a otro es un halógeno, se le llama “halogenación”.
En las fórmulas, los halógenos se representan por un “X”. Donde su representación general es R-X. Y debido a que los halógenos tienen 7 electrones de valencia, su estructura de Lewis es:
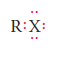
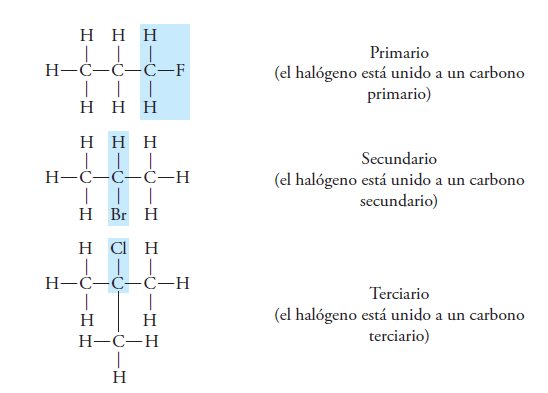
Estos compuestos se dividen en mono y poli halogenados, de acuerdo a su número de átomos de halógeno.
Los mono halogenados pueden ser primarios, secundarios o terciarios, dependiendo donde este el átomo de halógeno.
Los polihalogenados pueden tener dos o más átomos del mismo halógeno o de diferentes.
PROPIEDADES DE LOS COMPUESTOS HALOGENADOS
Los fluoruros y los cloruros son menos pesados que el agua, mientras que los bromuros y los yoduros son más densos que esta.
Todos los compuestos halogenados son insolubles en agua
En la vida cotidiana estos compuestos tienen muchos usos, tales son:
Clorometano (CH3-CL) es un gas que se usa como refrigerante
Triclorometano(CH-CL3) comúnmente llamado cloroformo, usado como anestésico.
Diclorodiflourmetano(CCL2-F2), mejor conocido como freon, es el gas usado para enfriar los refrigeradores, también usado en los aerosoles. Este gas es el mayor destructor de la capa de ozono, y su uso ha ido disminuyendo.
ÁCIDOS CARBOXÍLICOS
Estos compuestos también llamados ácidos orgánicos, se forman al oxidar un aldehído.
Es decir, se agrega un átomo de oxígeno al grupo funcional del aldehído (-CHO), o visto de otra manera, se sustituye es hidrogeno del aldehído por un grupo hidroxilo(-OH).
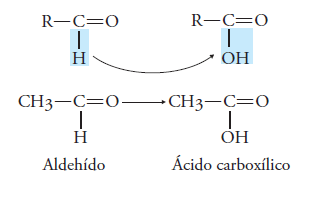
El grupo funcional de estos ácidos carboxílicos es: -COOH llamado carboxilo.
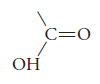
Resultado de la contracción entre carbonilo (-CO) e hidroxilo (-OH).
Su estructura de Lewis es:
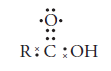
Y estos son algunos compuestos de ácidos carboxílicos:
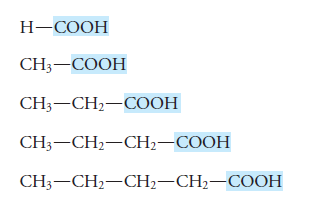
Los ácidos carboxílicos se pueden dividir en:
Ácidos Monocarboxilicos, tienen un grupo carboxílico
Ácidos dicarboxilicos, tienen 2 grupos carboxílicos
Ácidos Policarboxilicos tienen más grupos carboxílicos
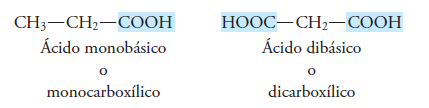
Un famoso acido es el ácido 2-hidroxi-1,2,3-propanotrioico, comúnmente llamado ácido cítrico.
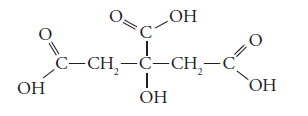
O el ácido acetilsalicílico, un ácido derivado del benceno y que es el principio activo de la aspirina.
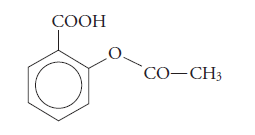
PROPIEDADES DE LOS ÁCIDOS CARBOXÍLICOS
Los ácidos que contienen hasta 3 carbonos en su cadena principal son totalmente solubles en agua, y de ahí va disminuyendo su solubilidad en agua, a partir del ácido octanoico, estos ácidos ya no son solubles en agua. La densidad de estos ácidos es menor que la del agua, excepto en los 2 primeros ácidos.
En la vida diaria podemos encontrar al ácido metanoico (ácido fórmico) en las hormigas y en el veneno de las abejas, se utiliza como antirreumático, antiséptico y como insecticida.
EL ácido ascórbico es la vitamina C
Y el ácido cítrico se encuentra en los limones y otras frutas.
ÉSTERES
Estos compuestos provienen de los ácidos carboxílicos u orgánicos, y se forman cuando el átomo de hidrogeno del grupo funcional de los ácidos (-COOH) se sustituye por un radical alquilo (R).
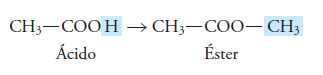
Esto ocurre cuando reacciona un ácido carboxílico con un alcohol:
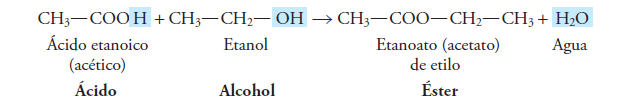
Así que el grupo funcional de los ésteres es: – COO –
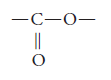
y su representación general es R – COO – R
Su molécula se puede ver así:
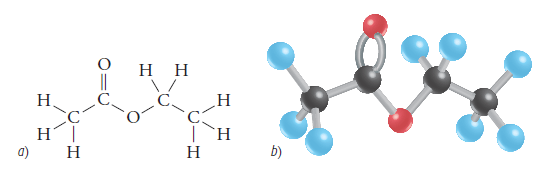
Los esteres en la vida cotidiana se presentan en abundancia, desde los aromas de las flores y las frutas, hasta los sabores de estos.
Ejemplos de esteres:
Acetato de etilo es el aroma de manzana
Butirato de etilo es el aroma de piña
ANHÍDRIDOS
Los anhídridos son compuestos que se pueden considerar como el resultado de eliminar 1 molécula de agua de 2 ácidos carboxílicos.
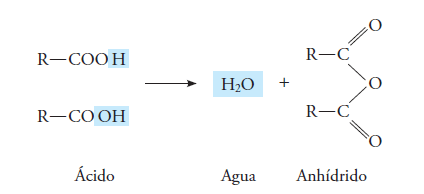
Su grupo funcional es – CO – O – OC – y su representación general es:
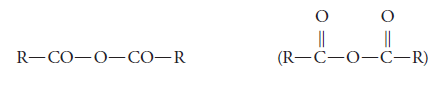
Los anhídridos se pueden dividir en simples o simétricos y mixtos o disimétricos. Son simples cuando los radicales alquilo (R) son iguales, y mixtos cuando los radicales son diferentes.
Anhídrido simple o simétrico:
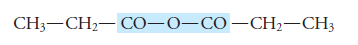
Anhídrido mixto o disimétrico:
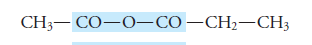
En la vida cotidiana, el anhídrido más importante es el anhídrido etanoico comúnmente llamado anhídrido acético, se utiliza desde componente de productos que absorben la humedad, y para hacer resinas, plásticos y colorantes hasta para hacer aspirina y otros fármacos.
AMINAS
¡Ojo!
Son aminas, no “animas”, como está en la guía. Ya lo reportamos a la universidad.
En términos generales las aminas, las amidas y los aminoácidos, son derivados nitrogenados de los hidrocarburos.
En el caso de las aminas, contienen un grupo “amino”, que se derivan del amoniaco (NH3).
Se forman cuando se sustituyen alguno o todos los hidrógenos del amoniaco por radicales alquilo.
Las aminas pueden ser primarias, si se sustituye solo un hidrogeno.

Son aminas secundarias si se sustituyen 2 hidrógenos y los radicales sustituyentes pueden ser iguales o diferentes. Si son iguales, es una amina secundaria simple, si son diferentes es una amina secundaria mixta.
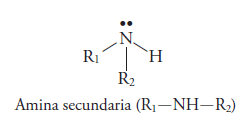
Y amina terciaria si los 3 hidrógenos son sustituidos por radiales alquilo(R). Si son iguales los radicales es una amina terciaria simple, si son diferentes son mixtas.
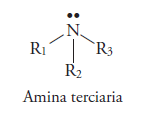
La estructura electrónica de Lewis de las aminas es:
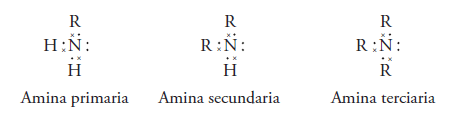
Si hay 2 o más grupos amino (-NH2) el compuesto es una diamina.
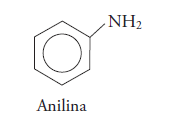
Y también existen aminas derivadas del benceno.
PROPIEDADES DE LAS AMINAS
La metilamina, la dimetilamina y la trimetilamina son gases a temperatura ambiente, tienen olor desagradable a amoniaco y a pescado en descomposición y son solubles en agua. Las aminas siguientes o más pesadas son liquidas y volátiles
Algunas de estas aminas forman parte de los compuestos del naylon, que se utiliza para hacer productos diversos, como medias, llantas, etc. Las aminas que son derivadas del benceno se emplean como medicamentos
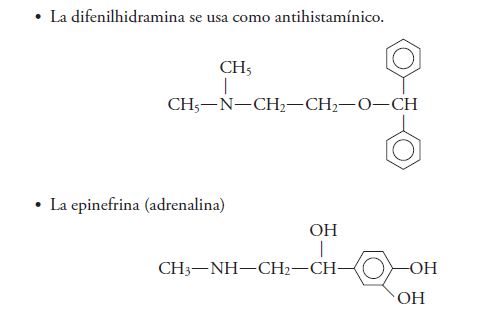
Y algunas aminas heterocíclicas son llamadas alcaloides, compuesto que está presente en las drogas como la nicotina, la cocaína, la morfina y la heroína.
AMIDAS
Estos compuestos son el resultado de sustituir uno de los hidrógenos de amoniaco (NH3) por un grupo acilo (R – CO – ) y los otros hidrógenos pueden sustituirse por cadenas hidrocarbonatadas.
Las amidas pueden ser:
Primarias, si solo se sustituye un hidrogeno
Secundarias si se sustituyen 2 hidrógenos
Y Terciarias si se sustituyen 3 hidrógenos.
El grupo funcional de la amida es:
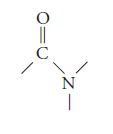
Las amidas pueden ser mono, di ó triamidas, según el número de grupos funcionales amida tengan en la molécula.
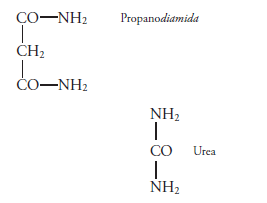
Ejemplos de amidas:
La urea es una diamida, producto final de la degradación de las proteínas, y fue la primera sustancia orgánica que se pudo sintetizar en el laboratorio
La urea de utiliza para producir productos nitrogenados tales como plásticos y fertilizantes.
La sacarina es una amida sintética que se utiliza como sustituto del azúcar.
Y algunas amidas cíclicas constituyen sustancias llamadas barbitúricos, que actúan como hipnóticos y sedantes.
AMINOÁCIDOS
Los aminoácidos son compuestos formados por un grupo carboxilo (-COOH) y un grupo amino (-NH2).
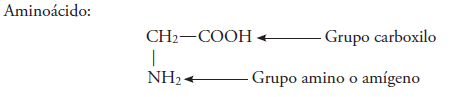
El grupo amino se encuentra unido a la cadena hidrocarbonatada que también contiene al grupo carboxilo.
Su grupo funcional es:
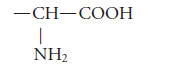
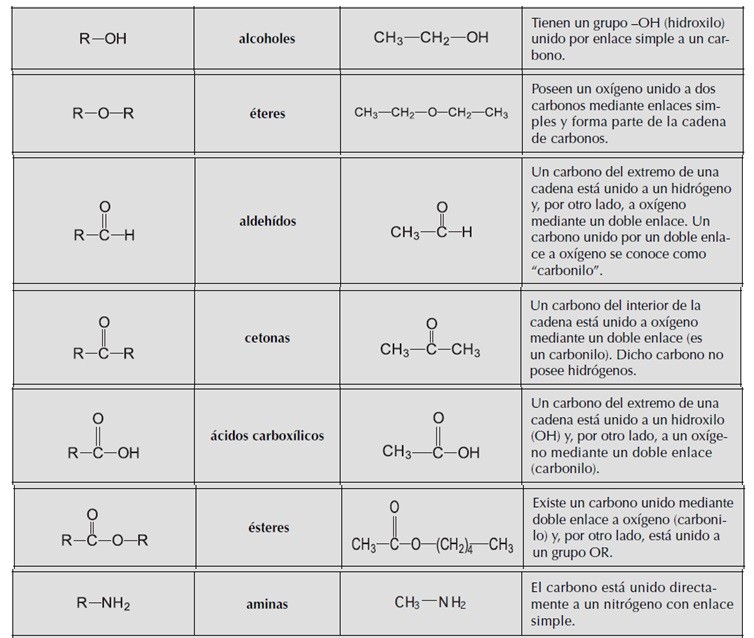
RESUMEN DE LOS GRUPOS FUNCIONALES:
Mas ejemplos, ejercicios y preguntas clave de examen, en nuestras guías digitales.
-
 Guía UNAM Área 4 2023Producto rebajado$450.00
Guía UNAM Área 4 2023Producto rebajado$450.00 -
 Guía UNAM Área 3 2023Producto rebajado$450.00
Guía UNAM Área 3 2023Producto rebajado$450.00 -
 Guía UNAM Área 2 2023Producto rebajado$450.00
Guía UNAM Área 2 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 4-2023$80.00
Guía UNAM de Química Área 4-2023$80.00 -
 Guía UNAM de Química Área 3-2023$80.00
Guía UNAM de Química Área 3-2023$80.00 -
 Guía UNAM de Química Área 2-2023$90.00
Guía UNAM de Química Área 2-2023$90.00 -
 Guía UNAM Área 1 2023Producto rebajado$450.00
Guía UNAM Área 1 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 1-2023$80.00
Guía UNAM de Química Área 1-2023$80.00






Pingback: GRUPOS FUNCIONALES - Curso para la UNAM