LA ENERGÍA INTERNA
DEFINICIÓN DE ENERGÍA INTERNA
La energía interna de una sustancia es la suma de todos los diferentes tipos de energía “interna” de la sustancia.
Entre las energías que contiene una sustancia están:
1.- Energía cinética de las moléculas
2.- Energía eléctrica entre las partículas subatómicas (electrones, protones y neutrones)
3.- Otras energías
También a la energía interna se le llama en ocasiones energía química.
CARACTERÍSTICAS GENERALES DE LA ENERGÍA INTERNA
La energía interna presenta las siguientes características generales:
1.- La energía interna es una función de estado
2.- La unidad de medida de la energía interna son los Joules.
3.- Debido a la complejidad de medir el valor absoluto de la energía interna de una sustancia, regularmente lo que se mide son los cambios entre un estado y otro.
CAMBIO DE ENERGÍA INTERNA
Los cambios de energía interna se pueden medir de dos formas diferentes:
1.- A través de diferencias entre las energías internas de los productos y los reactivos
2.- A través del intercambio de energía entre el sistema (reacción química) y sus alrededores.
1.- A través de diferencias entre las energías internas de los productos y los reactivos
El cambio de energía interna que se representa por ΔE es igual a la diferencia entre la energía interna de los productos menos la energía interna de los reactivos.
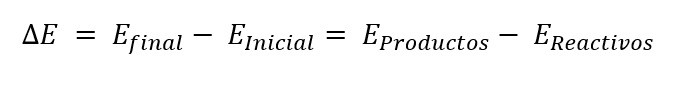
2.- A través del intercambio de energía entre el sistema (reacción química) y sus alrededores.
Para medir el cambio de energía interna (ΔE) utilizamos la 1era ley de la termodinámica.
1era LEY DE LA TERMODINÁMICA
La primera ley de la termodinámica establece que, en un proceso químico, la variación de la energía interna (ΔE) es igual a la transferencia de energía en forma de calor (Q) y trabajo (W) entre el sistema y su entorno.

Es decir, el cambio de energía interna en un sistema se tiene que expresar en forma de calor o en forma de trabajo con los alrededores. Y que es exactamente lo mismo que decir:
“La energía es la capacidad para realizar trabajo o para transferir calor”.
CONVENCIONES EN LOS SIGNOS DE LA 1RA LEY DE LA TERMODINÁMICA
Por convención utilizamos los siguientes signos:
Si el sistema absorbe calor de los alrededores: Q es positivo
Si el sistema libera calor a los alrededores: Q es negativo
Si los alrededores realizan trabajo sobre el sistema: W es positivo
Si el sistema realiza trabajo sobre los alrededores: W es negativo
ECUACIÓN TERMOQUÍMICA
Para expresar los cambios de calor en una ecuación química utilizamos las siguientes expresiones.
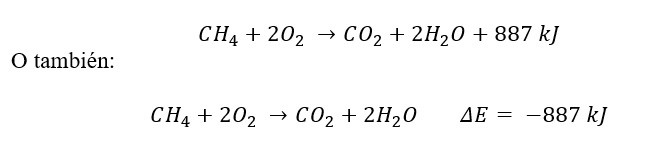
UNIDAD DE MEDIDA DE LA ENERGÍA INTERNA
La unidad de medida de la energía interna es el Joule
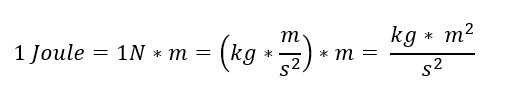
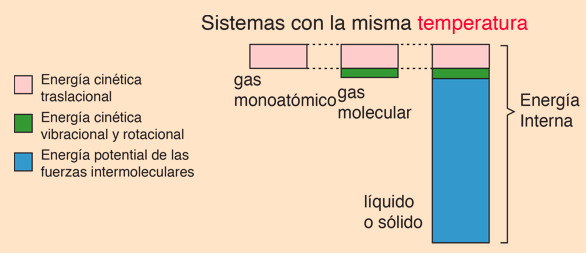
COMPARACIÓN DE ENERGÍAS INTERNAS DE DIFERENTES SISTEMAS
Con la intención de que puedas tener una idea mejor de la energía interna, se comparan los siguientes sistemas:
1.- Un gas monoatómico.
Te puedes imaginar este gas como si fuera un conjunto de canicas chocando entre ellas, donde su energía interna solamente se consideraría la suma de todas las energías cinéticas de estas canicas
2.- Un gas molecular
En este sistema, las entidades que chocan, ya serian conjuntos de canicas diferentes que chocan, por lo que, su energía interna, además de la energía cinética de cada una de ellas, también se tendría que considerar la energía de rotación de estos conjuntos de canicas.
3.- Un solido
En este sistema, además de las energías anteriores, ahora los conjuntos de canicas se atraen (por eso forman el sólido) así que esta energía se suma a la anterior para obtener la energía interna total del sistema.
Mas ejemplos, ejercicios y preguntas clave de examen, en nuestras guías digitales.
-
 Guía UNAM Área 4 2023Producto rebajado$450.00
Guía UNAM Área 4 2023Producto rebajado$450.00 -
 Guía UNAM Área 3 2023Producto rebajado$450.00
Guía UNAM Área 3 2023Producto rebajado$450.00 -
 Guía UNAM Área 2 2023Producto rebajado$450.00
Guía UNAM Área 2 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 4-2023$80.00
Guía UNAM de Química Área 4-2023$80.00 -
 Guía UNAM de Química Área 3-2023$80.00
Guía UNAM de Química Área 3-2023$80.00 -
 Guía UNAM de Química Área 2-2023$90.00
Guía UNAM de Química Área 2-2023$90.00 -
 Guía UNAM Área 1 2023Producto rebajado$450.00
Guía UNAM Área 1 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 1-2023$80.00
Guía UNAM de Química Área 1-2023$80.00



