ESTRUCTURA TETRAÉDRICA DEL CARBONO
Gracias a la hibridación de los orbitales del carbono, los 4 electrones de su capa más externa forman una estructura tetraédrica, donde cada electrón ocupa un vértice, como se ve en la siguiente figura.
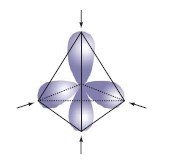
También se pueden representar estos 4 electrones de valencia del carbono, con 4 líneas rectas alrededor del símbolo del carbono.
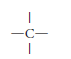
DIAGRAMA ORBITAL E HIBRIDACIÓN DEL CARBONO
Su diagrama orbital es:
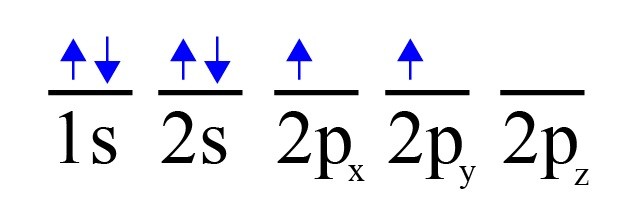
Con este diagrama, concluiríamos que el carbono solo tiene 2 electrones NO apareados, y por lo tanto solo tendría una valencia de 2.
Pero se sabe que el carbono tiene de valencia 2, -4 y 4, es decir 4 electrones que no están apareados y con los cuales puede hacer enlaces con otros elementos.
Para poder explicar esta aparente contradicción, aparece un fenómeno llamado “hibridación”,
HIBRIDACIÓN DEL CARBONO
La hibridación es un fenómeno atómico donde un suborbital se fusiona con otros suborbitales.
En el caso del Carbono el suborbital 2s se fusiona con los otros 3 suborbitales 2p, para dar como resultado 4 suborbitales sp3 y de esta forma, los 4 electrones que tiene el carbono en su nivel de energía 2 se reparten en 4 suborbitales híbridos.
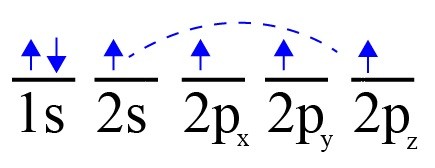
“Esta esta estructura tetraédrica (gracias a la hibridación de sus orbitales) le da la capacidad al carbono para formar enlaces con otros carbonos y formar diferentes tipos de cadenas”.
Próximo tema como lo marca la guía de la UNAM:
6.1.2 Tipos de enlace carbono-carbono: estructura y modelos
Mas ejemplos, ejercicios y preguntas clave de examen, en nuestras guías digitales.
-
 Guía UNAM Área 4 2023Producto rebajado$450.00
Guía UNAM Área 4 2023Producto rebajado$450.00 -
 Guía UNAM Área 3 2023Producto rebajado$450.00
Guía UNAM Área 3 2023Producto rebajado$450.00 -
 Guía UNAM Área 2 2023Producto rebajado$450.00
Guía UNAM Área 2 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 4-2023$80.00
Guía UNAM de Química Área 4-2023$80.00 -
 Guía UNAM de Química Área 3-2023$80.00
Guía UNAM de Química Área 3-2023$80.00 -
 Guía UNAM de Química Área 2-2023$90.00
Guía UNAM de Química Área 2-2023$90.00 -
 Guía UNAM Área 1 2023Producto rebajado$450.00
Guía UNAM Área 1 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 1-2023$80.00
Guía UNAM de Química Área 1-2023$80.00





