ECUACIÓN DE ESTADO DE LOS GASES IDEALES
CONCEPTO DE ESTADO
Un estado es un conjunto de características o variables que describen a un estado de otro.
En termodinámica, las propiedades o variables que describen el estado de un sistema son:
1.- El Volumen,
2.- Su Presión y
3.- Su Temperatura.
El valor de cada una de estas variables determina el estado de ese gas en ese momento.
ECUACIÓN DE ESTADO
Una ecuación de estado es una ecuación donde se relacionan el conjunto de propiedades o variables que definen al estado.
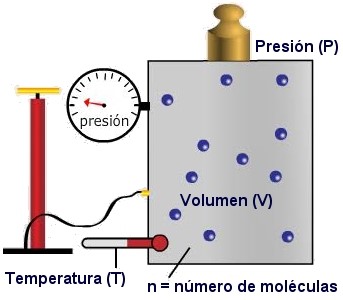
DEFINICIÓN DE UN GAS IDEAL:
Un gas ideal es el modelo de un gas teórico que cumple con la ley de estado de los gases ideales.
Las propiedades generales que tiene un gas ideal son:
1.- No existen fuerzas eléctricas de interacción entre sus moléculas
2.- Los choques entre las moléculas son elásticos
3.- Una alta temperatura o una alta presión no alteran las propiedades anteriores
Gracias a este modelo del gas ideal y su ecuación se pueden hacer predicciones bastantes aceptables de muchos fenómenos de la naturaleza con gases simples.
ECUACIÓN DE ESTADO DE LOS GASES IDEALES
La ecuación de estado de un gas ideal establece que: El producto de la presión por el volumen es igual a el número de moles por la constante del gas ideal por la temperatura.

UNIDADES DE LA CONSTANTE DEL GAS IDEAL
En el sistema internacional utilizando Pascales como unidad de presión, metros cúbicos como unidad de volumen y grados kelvin como unidad de temperatura, tenemos que el valor de la constante de los gases ideales es:
R = 8.31444 J / (mol * K)
Para cálculos químicos, regularmente se utilizan atmosferas como unidad de presión, litros como unidad de volumen y también grados kelvin como unidad de temperatura, por lo que el valor de la constante de los gases ideales es:
R = 0.08206 (L * atm) / (mol * K)
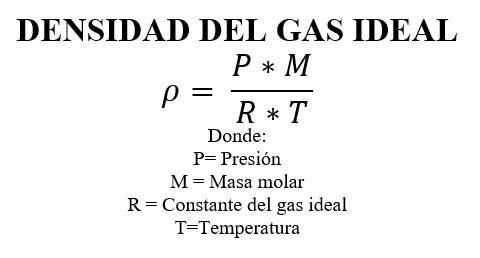
DENSIDAD DEL GAS IDEAL
Relacionando la fórmula de densidad (ρ = masa total / volumen) con nuestra ecuación de estado del gas ideal tenemos una expresión para la densidad.
CAMBIOS ENTRE ESTADOS EN EL GAS IDEAL
Cuando modificamos variables de un sistema como la presión, el volumen y la temperatura, pero dejamos fijo el número de moles, es decir, no agregamos ni quitamos masa a nuestro sistema, y además, por supuesto, la constante del gas ideal es la misma entre los dos estados, tenemos que la expresión del gas ideal es igual a:

O lo que es lo mismo, la relación de las variables de un estado termodinámico es igual a la relación de las variables de otro estado termodinámico
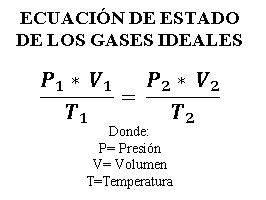
Es decir, que, si modifica alguna variable termodinámica de un estado, las demás variables aumentan o disminuye, pero la relación tiene el mismo valor.
¡Ojo!
Como observaras, si haces un cambio en alguna variable termodinámica de un estado, varían las otras en automático.
Pero gracias a que podemos alterar los experimentos, podemos hacer que alguna de las variables implicadas en la ecuación de estado del gas ideal sea constante.
Así que, si modificamos nuevamente una variable, solo se modifica otra, (porque hemos dejado fija la tercera).
Como son 3 variables, tenemos 3 formas de la ecuación anterior, dejando una de ellas fija.
LEY DE BOYLE
Variable fija: Temperatura
“La ley de Boyle dice que, para una masa dada a temperatura constante, el volumen varía de manera inversamente proporcional a la presión que recibe”.
Es decir, que, si disminuyes el volumen del recipiente, tienen que aumentar la presión, y si aumentas el volumen, tienen que disminuir la presión.
Recuerda que todo esto es a temperatura constante.
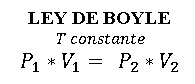
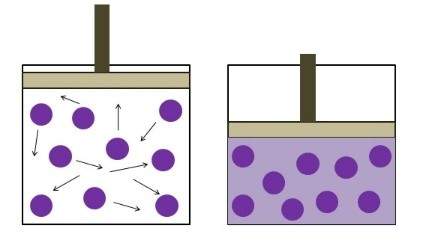
LEY DE CHARLES
Variable fija: Presión
Para una masa dada a una presión constante, el volumen del gas varia de una manera directamente proporcional a la temperatura.
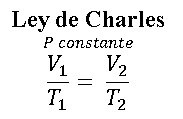
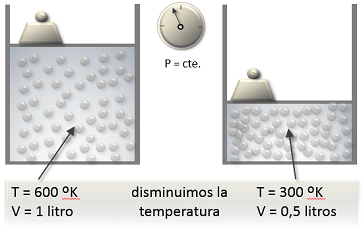
LEY DE GAY-LUSSAC
Variable fija: Volumen
Para una masa dada a volumen constante, la presión el gas varía de una manera directamente proporcional a la temperatura.
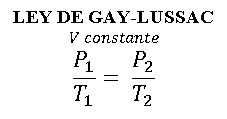
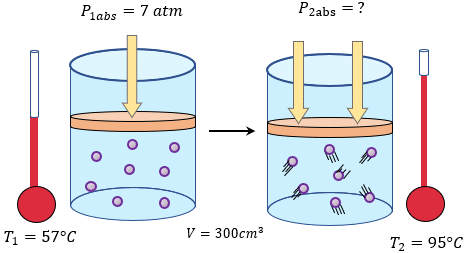
Es decir que, si aumentas la presión aumenta la temperatura, y si disminuyes la presión, disminuye la temperatura
EJEMPLOS:
1.- Tenemos un gas en un cilindro con tapa movible. El gas está a 400 C de temperatura, con una presión de 800 mm de Hg y el cilindro está a un volumen de 50cm3. Determina que volumen ocuparía el gas si estuviera a 00 C. a la misma presión.
Primero determinamos la formula a utilizar:
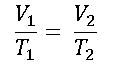
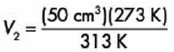
Después despejamos la variable desconocida y sustituimos nuestros datos:
Realizamos las operaciones y obtenemos:
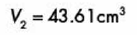
Mas ejemplos, ejercicios y preguntas clave de examen, en nuestras guías digitales.
-
 Guía UNAM Área 4 2023Producto rebajado$450.00
Guía UNAM Área 4 2023Producto rebajado$450.00 -
 Guía UNAM Área 3 2023Producto rebajado$450.00
Guía UNAM Área 3 2023Producto rebajado$450.00 -
 Guía UNAM Área 2 2023Producto rebajado$450.00
Guía UNAM Área 2 2023Producto rebajado$450.00 -
 Guía UNAM de Física Área 4-2023$90.00
Guía UNAM de Física Área 4-2023$90.00 -
 Guía UNAM de Física Área 3-2023$90.00
Guía UNAM de Física Área 3-2023$90.00 -
 Guía UNAM de Física Área 2-2023$90.00
Guía UNAM de Física Área 2-2023$90.00 -
 Guía UNAM Área 1 2023Producto rebajado$450.00
Guía UNAM Área 1 2023Producto rebajado$450.00 -
 Guía UNAM de Física Área 1-2023$90.00
Guía UNAM de Física Área 1-2023$90.00





