LA ENTALPIA
DEFINICIÓN DE ENTALPIA
La entalpia representada por la letra “H”, se define como el flujo de calor en los procesos químicos que se efectúan a presión constante y es igual a la energía interna más el producto de la presión y el volumen del sistema.
FORMULA DE LA ENTALPIA
La entalpia es igual a la energía interna más el producto de la presión y el volumen del sistema.
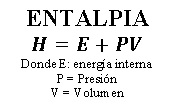
A pesar de que tenemos la formula anterior, regularmente no se calcula la entalpia de un sistema, sino que solamente se calcula el cambio de la entalpia del sistema.
CAMBIO DE LA ENTALPIA DE UN SISTEMA
Como ya dijimos en la definición, la entalpia es sobre procesos que ocurren a presión constante, por lo que tenemos que el cambio en la entalpia de un sistema es igual a el cambio en la energía interna del sistema más el producto de la presión (constante) por el cambio en el volumen.
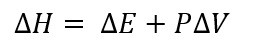
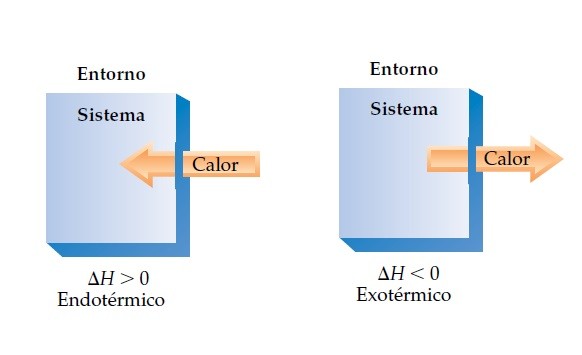
Si ΔH es positivo, “q” es positiva y significa que el sistema ha ganado calor del entorno (PROCESO ENDOTÉRMICO).
Si ΔH es negativo, “q” es negativa y significa que el sistema ha perdido calor del entorno (PROCESO EXOTÉRMICO).
ENTALPIA EN LAS REACCIONES QUÍMICAS
ENTALPIA DE REACCIÓN O CALOR DE REACCIÓN
La entalpia de reacción o también llamado calor de reacción es el cambio de entalpia que acompaña a una reacción química y se puede expresar como:
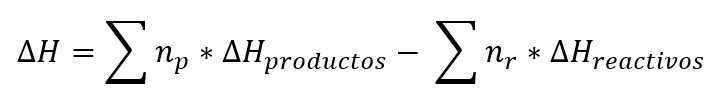
Donde n es igual a los coeficientes de los productos y de los reactivos respectivamente
Ejemplos de entalpia de reacción:
En la combustión de hidrogeno a presión constante, encontramos que el sistema libera 483 kJ de calor. Y lo podemos expresar de la siguiente forma:
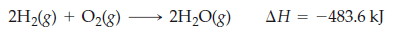
Tenemos que ΔH es negativo, por lo tanto, es una reacción exotérmica.

Mas ejemplos, ejercicios y preguntas clave de examen, en nuestras guías digitales.
-
 Guía UNAM Área 4 2023Producto rebajado$450.00
Guía UNAM Área 4 2023Producto rebajado$450.00 -
 Guía UNAM Área 3 2023Producto rebajado$450.00
Guía UNAM Área 3 2023Producto rebajado$450.00 -
 Guía UNAM Área 2 2023Producto rebajado$450.00
Guía UNAM Área 2 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 4-2023$80.00
Guía UNAM de Química Área 4-2023$80.00 -
 Guía UNAM de Química Área 3-2023$80.00
Guía UNAM de Química Área 3-2023$80.00 -
 Guía UNAM de Química Área 2-2023$90.00
Guía UNAM de Química Área 2-2023$90.00 -
 Guía UNAM Área 1 2023Producto rebajado$450.00
Guía UNAM Área 1 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 1-2023$80.00
Guía UNAM de Química Área 1-2023$80.00