ELECTRONEGATIVIDAD Y TIPOS DE ENLACE: IÓNICO Y COVALENTE
DEFINICIONES INICIALES DE ELECTRONEGATIVIDAD
VALENCIA
La valencia de un elemento es la capacidad que tiene para combinarse con otros elementos, ya sea que pierda o que gane electrones con el objetivo de cumplir con la regla del octeto, es decir, para tener 8 electrones en su último orbital.
La valencia de un elemento se mide con el número de electrones que necesita o que le sobran para tener completo su Octeto de Lewis.
La valencia de los gases nobles, por tanto, será cero, ya que tienen completo su octeto de Lewis (excepto el Helio).
En el caso del sodio, la valencia es 1, ya que tiene un solo electrón de valencia, si pierde un electrón se queda con el último nivel completo.
ELECTRONES DE VALENCIA
Los electrones de valencia son los electrones que se encuentran en el último nivel energético del átomo, y que intentan formar (ganando o perdiendo electrones) el Octeto de Lewis.
Estos electrones son los principales responsables de las interacciones con los demás átomos.
ELECTRONEGATIVIDAD
La electronegatividad es la atracción que ejerce un átomo o el núcleo de este átomo sobre los electrones compartidos en la unión con otro átomo.
Así que, si 2 átomos se unen, el átomo con mayor electronegatividad, atraerá con mayor fuerza a los electrones que se comparten, (a los de el mismo y a los del otro átomo), creando con esto, un lado ligeramente negativo y el otro lado ligeramente positivo
Si los dos átomos tienen la misma electronegatividad, los electrones compartidos se distribuirán simétricamente en los dos átomos.
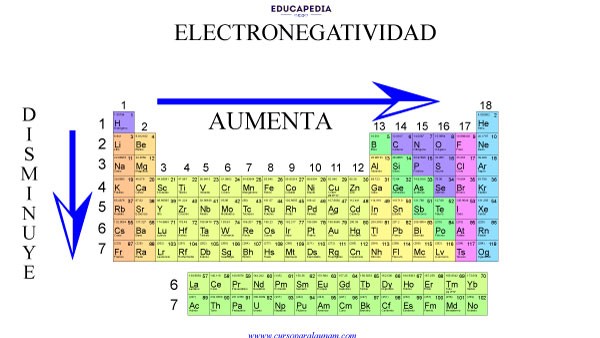
COMPORTAMIENTO DE LA ELECTRONEGATIVIDAD EN LA TABLA PERIÓDICA
Dentro de cada familia o grupo (columnas), la electronegatividad va disminuyendo de arriba hacia abajo.
Es decir, los elementos con bajo número atómico (los primeros elementos) tienen mayor electronegatividad que los de alto número atómico.
Pero ojo, disminuye solo cuando los electrones que se agregan lo hacen en otro nivel energético
Si los electrones que se van agregando lo hacen sobre el mismo nivel energético, entonces se observa lo que pasa en los periodos (renglones) de la tabla periódica.
En los periodos aumenta de izquierda a derecha, con el aumento del número atómico, pero aquí los electrones que se van agregando lo hacen sobre el mismo nivel energético.
¡Ojo!
Aunque se pueda ver cierta regularidad en la electronegatividad en los elementos de la tabla periódica, lo cierto es que también depende de otros factores, como, por ejemplo, el elemento al cual está unido.
También, gracias a esta propiedad podemos reforzar la clasificación de la tabla en metales y no metales de la siguiente manera:
Elementos con alta electronegatividad generalmente serán no metales
Elementos con baja electronegatividad generalmente serán metales
Recuerda que en la tabla periódica los metales están del lado izquierdo con baja electronegatividad, y los no metales del lado derecho con alta electronegatividad. (Los gases nobles no tiene electronegatividad es por eso que no interactúan con otros elementos).
Mas ejemplos y preguntas de examen en nuestras guías digitales.
TIPOS DE ENLACE
Debido a la electronegatividad de los elementos se pueden dar dos tipos de enlaces:
Si la diferencia de electronegatividades es muy alta entre los elementos que se enlazan, entonces el núcleo del elemento con alta electronegatividad “arrancara” los electrones de valencia del otro elemento formando un enlace iónico
Si la diferencia de electronegatividades no es tan alta, los electrones de valencia permanecen “compartidos” entre los elementos unidos formando un enlace covalente.
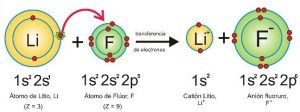
ENLACE IÓNICO
El enlace iónico es cuando un átomo “transfiere” sus electrones a otro átomo, para lograr la estabilidad.
Como resultado, quedan dos iones con cargas opuestas que se atraen para formar un compuesto químico.
Este tipo de enlace es común con elementos con una electronegatividad muy diferente, como un metal y un no metal.
¡Ojo!
La fuerza de unión es la fuerza de atracción que hay entre un ion positivo (el átomo que transfirió electrones) y un ion negativo (el átomo que recibió los electrones).
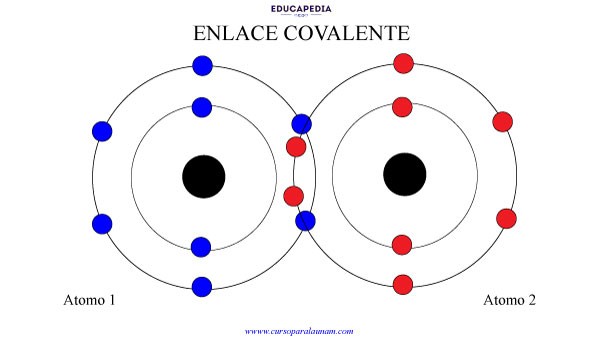
ENLACE COVALENTE
El enlace covalente es cuando los electrones solo se “comparten” en lugar de transferirse.
Así que 2 o más elementos pueden compartir sus electrones para tener la configuración estable y las fuerzas que los unen son la fuerza de atracción de un núcleo con los electrones compartidos y la fuerza de atracción del otro núcleo con los mismos electrones compartidos.
Es decir, los dos núcleos se pelean por tener los electrones compartidos.
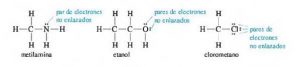
Los electrones No enlazados son electrones de la capa de valencia que no se comparten entre átomos, también conocidos como par solitario de electrones.
TIPOS DE ENLACE COVALENTE (SEGÚN QUIEN COMPARTE LOS ELECTRONES)
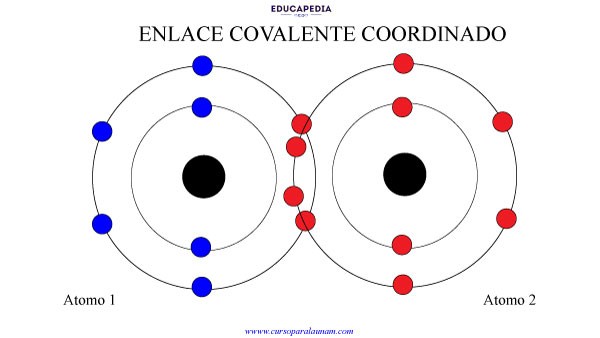
ENLACE COVALENTE COORDINADO
Este enlace se da cuando un solo elemento “pone” todos los electrones que se vayan a compartir.
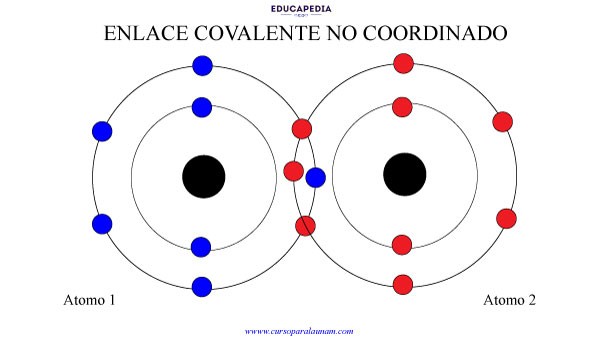
ENLACE COVALENTE NO COORDINADO
En este caso, los dos elementos participan con alguno de sus electrones.
TIPOS DE ENLACE COVALENTE (SEGÚN EL NUMERO DE ELECTRONES COMPARTIDOS)
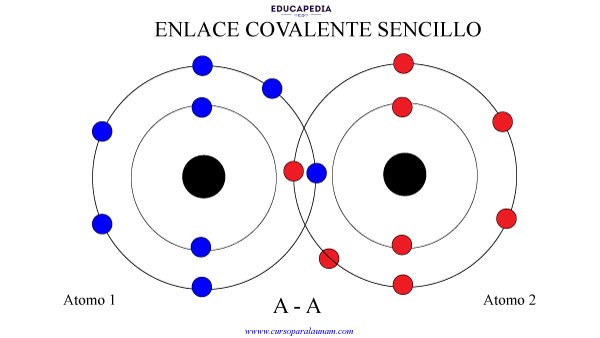
ENLACE COVALENTE SENCILLO
Cuando 2 elementos comparten un electrón cada uno. Para formar un par de electrones compartido.
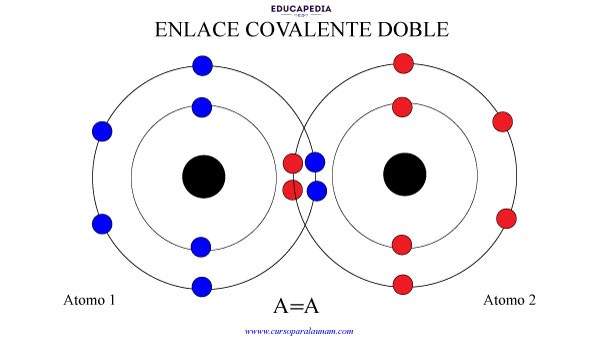
ENLACE COVALENTE DOBLE
Cuando 2 elementos comparten 2 electrones cada uno. Para formar 2 pares de electrones compartidos.
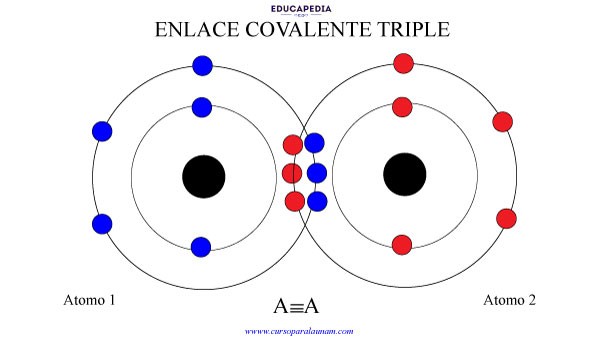
ENLACE COVALENTE TRIPLE
Cuando 2 elementos comparten 3 electrones cada uno. Para formar 3 pares de electrones compartidos.
TIPOS DE ENLACE COVALENTE (SEGÚN EL TIPO DE ÁTOMOS ENLAZADOS)
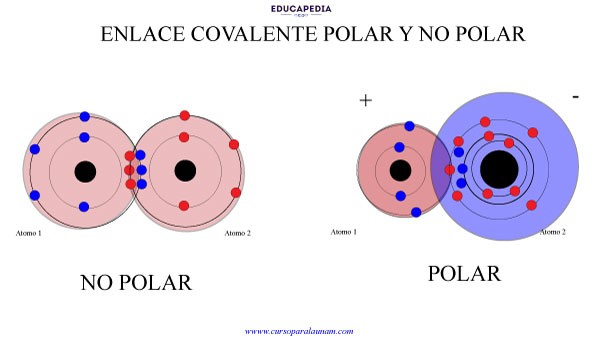
ENLACE COVALENTE NO POLAR
El enlace covalente no polar es cuando los electrones que se comparten entre los átomos, lo hacen de manera simétrica.
Es decir, los núcleos de cada átomo atraen con la misma fuerza a los electrones que se comparten y esto se da cuando los átomos unidos son del mismo elemento.
ENLACE COVALENTE POLAR
El enlace covalente polar es cuando los electrones son atraídos con diferentes fuerzas entre los núcleos de los átomos, creando así una molécula con un lado ligeramente positivo y el otro ligeramente negativo.
Este enlace se da cuando los átomos enlazados son de diferentes elementos.
POLARIDAD
La polaridad de enlace se mide por medio del momento dipolar, el cual se define como la cantidad de separación de carga multiplicada por la longitud del enlace.
Ejemplos:
1.- En una molécula de 2 átomos de hidrogeno, cada átomo compartirá su electrón (enlace sencillo). Como la fuerza del núcleo de cada átomo de hidrogeno atrae con la misma intensidad a los electrones compartido este enlace será un enlace no polar.
Es decir, este enlace es un enlace covalente sencillo no polar.
Mas ejemplos, ejercicios y preguntas clave de examen, en nuestras guías digitales.
-
 Guía UNAM Área 4 2023Producto rebajado$450.00
Guía UNAM Área 4 2023Producto rebajado$450.00 -
 Guía UNAM Área 3 2023Producto rebajado$450.00
Guía UNAM Área 3 2023Producto rebajado$450.00 -
 Guía UNAM Área 2 2023Producto rebajado$450.00
Guía UNAM Área 2 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 4-2023$80.00
Guía UNAM de Química Área 4-2023$80.00 -
 Guía UNAM de Química Área 3-2023$80.00
Guía UNAM de Química Área 3-2023$80.00 -
 Guía UNAM de Química Área 2-2023$90.00
Guía UNAM de Química Área 2-2023$90.00 -
 Guía UNAM Área 1 2023Producto rebajado$450.00
Guía UNAM Área 1 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 1-2023$80.00
Guía UNAM de Química Área 1-2023$80.00



