LA ENTROPIA
DEFINICIÓN INFORMAL DE ENTROPÍA
De manera muy general, la entropía es la cantidad de desorden que hay en un sistema (piensa en tu recamara donde estudias). Entre más entropía más desorden.
Y el desorden, es algo que “no nos ayuda a hacer nuestras labores”, por el contrario, necesitamos invertirle tiempo y esfuerzo en arreglar nuestro desorden y después ponernos a trabajar.
DEFINICIÓN TERMODINÁMICA DE ENTROPÍA
“La entropía es una función de estado termodinámica que mide la dispersión de la energía y la materia”.
Cuanto más grande es la dispersión de la energía, tanto mayor será su entropía.
Ahora que ya entendimos un poco lo que es entropía, observarnos en nuestra realidad algo que se repite en la mayoría de fenómenos naturales y que es establecido por la 2da ley de la termodinámica.
2DA LEY DE LA TERMODINÁMICA
“La 2da Ley de la Termodinámica establece que en un sistema termodinámico en equilibrio los valores que toman ciertos parámetros maximizan una magnitud llamada Entropía que está en función de estos parámetros termodinámicos”.
Esto quiere decir de forma simplificada que todos los sistemas termodinámicos tienden de manera espontánea a cierto estado donde la entropía es máxima.
O también, de forma común, se dice que los estados termodinámicos tienen al desorden.
Ejemplos de la Segunda Ley de la Termodinámica:
1.- Cuando calientas en una olla agua para tu café, has ordenado un poco la energía porque has almacenado energía en el agua, pero si la dejas en tu taza por un largo tiempo, esta energía se habrá dispersado en el ambiente y ya no tendrás tu café caliente.
2.- Si conectas dos tanques, uno con oxígeno y el otro con hidrogeno, al final tendrás los dos tanques con la misma mezcla de gases
CARACTERÍSTICAS GENERALES DE LA ENTROPÍA
1.- La entropía de una sustancia pura cristalina perfecta (perfectamente ordenada) es de cero, en el cero absoluto de temperatura (0 K).
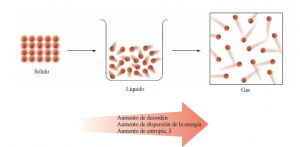
2.- La entropía de cualquier muestra aumenta si su temperatura aumenta.
3.- La entropía de un gas aumenta si su volumen aumenta.
4.- La mezcla de sustancias o la disolución de un sólido en un líquido causan un incremento de la entropía.
5.- El incremento en el número de partículas en una sustancia causa un aumento de la entropía.
6.- En la mayoría de las reacciones químicas orgánicas, el cambio en la entalpia, es mucho mayor y más determinante en la reacción que el cambio en la entropía del sistema, por esta razón, casi no se calcula el cambio de la entropía, salvo algunas excepciones, donde la entalpia es muy pequeña y la entropía adquiere cierto carácter determinante en la reacción.
7.- Debido a que el concepto de entalpia no puede predecir por sí sola que procesos químicos serán espontáneos (que se dan sin la ayuda de agentes externos al sistema), el concepto de entropía si nos ayuda a identificar este tipo de procesos antes de su reacción. (Véase el siguiente capítulo: Energía libre y espontaneidad)
Mas ejemplos, ejercicios y preguntas clave de examen, en nuestras guías digitales.
-
 Guía UNAM Área 4 2023Producto rebajado$450.00
Guía UNAM Área 4 2023Producto rebajado$450.00 -
 Guía UNAM Área 3 2023Producto rebajado$450.00
Guía UNAM Área 3 2023Producto rebajado$450.00 -
 Guía UNAM Área 2 2023Producto rebajado$450.00
Guía UNAM Área 2 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 4-2023$80.00
Guía UNAM de Química Área 4-2023$80.00 -
 Guía UNAM de Química Área 3-2023$80.00
Guía UNAM de Química Área 3-2023$80.00 -
 Guía UNAM de Química Área 2-2023$90.00
Guía UNAM de Química Área 2-2023$90.00 -
 Guía UNAM Área 1 2023Producto rebajado$450.00
Guía UNAM Área 1 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 1-2023$80.00
Guía UNAM de Química Área 1-2023$80.00





