POLARIDAD Y PUENTES DE HIDRÓGENO EN LA MOLÉCULA DEL AGUA
POLARIDAD EN LA MOLÉCULA DEL AGUA
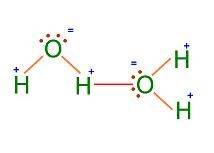
Gracias a la estructura que forman la unión de los átomos de hidrogeno con el átomo de oxígeno (H2O) y gracias también a la mayor electronegatividad que tiene el átomo de oxígeno para con los electrones que se comparten, se genera un lago ligeramente negativo del lado del oxígeno y un lago ligeramente positivo del lado de los dos hidrógenos.
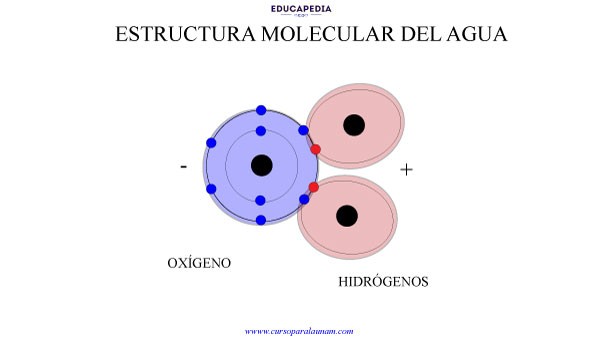
Por eso se dice que la molécula del agua es de tipo polar.
Esta polaridad de la molécula del agua (que tenga una región negativa y otra positiva), causa que se pueda interrelacionar con otras moléculas de agua con mucha facilidad. Sus lados positivos se atraen con los lados negativos de las otras moléculas y viceversa.
PUENTES DE HIDROGENO
Los puentes de hidrógenos son aquellas uniones donde los hidrógenos unidos a un átomo provocan uniones con otros átomos o moléculas.
En la molécula del agua estás uniones son causadas por la polaridad que se forma con el átomo de oxígeno.
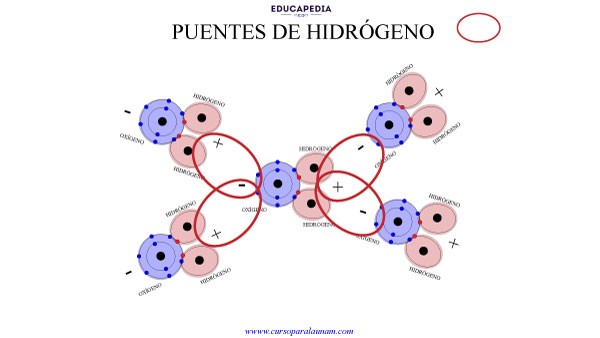
Los puentes de hidrogeno también se presentan cuando se unen con otras moléculas electronegativas, como el oxígeno, el nitrógeno y el flúor.
¡Ojo!
Los puentes de hidrogeno que unen las moléculas del agua son los responsables que determinan el punto de ebullición y la capacidad calorífica del agua.
Mas ejemplos, ejercicios y preguntas clave de examen, en nuestras guías digitales.
-
 Guía UNAM Área 4 2023Producto rebajado$450.00
Guía UNAM Área 4 2023Producto rebajado$450.00 -
 Guía UNAM Área 3 2023Producto rebajado$450.00
Guía UNAM Área 3 2023Producto rebajado$450.00 -
 Guía UNAM Área 2 2023Producto rebajado$450.00
Guía UNAM Área 2 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 4-2023$80.00
Guía UNAM de Química Área 4-2023$80.00 -
 Guía UNAM de Química Área 3-2023$80.00
Guía UNAM de Química Área 3-2023$80.00 -
 Guía UNAM de Química Área 2-2023$90.00
Guía UNAM de Química Área 2-2023$90.00 -
 Guía UNAM Área 1 2023Producto rebajado$450.00
Guía UNAM Área 1 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 1-2023$80.00
Guía UNAM de Química Área 1-2023$80.00




Hola, gracias, es una muy útil información, me gustaría agregar al decir que la estructura ángular del agua ayuda a que se formen puentes de hidrógeno.
Muchas Gracias por tu aportación Alan. Aunque nos gustaría remarcar que los puentes de hidrógeno dependen de la interacción entre la electronegatividad de los átomos que interactuan por medio de átomos de hidrógeno. Saludos.