REACCIONES DE ÓXIDO-REDUCCIÓN
DEFINICIÓN DE REACCIONES DE ÓXIDO-REDUCCIÓN
Las recciones de oxido-reducción son las reacciones químicas donde uno o más electrones se transfieren entre los reactivos provocando un cambio en el estado de oxidación de cada uno de ellos.
Las reacciones de óxido – reducción también son llamadas reacciones redox.
Las reacciones redox siempre se generan en un par de semirreacciones, ya que primero un elemento pierde electrones y después el otro los gana.
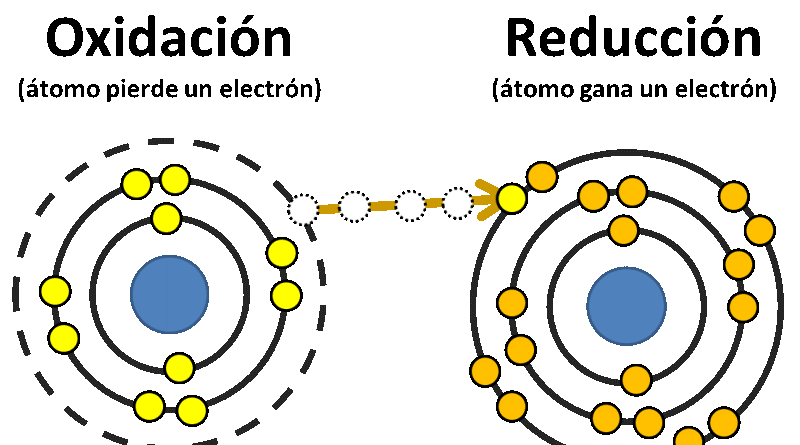
OXIDACIÓN
La oxidación es la semirreacción que implica la perdida de electrones por parte de un elemento o compuesto químico
REDUCCIÓN
La reducción es la semirreacción que implica la ganancia de electrones por parte de un elemento o compuesto químico
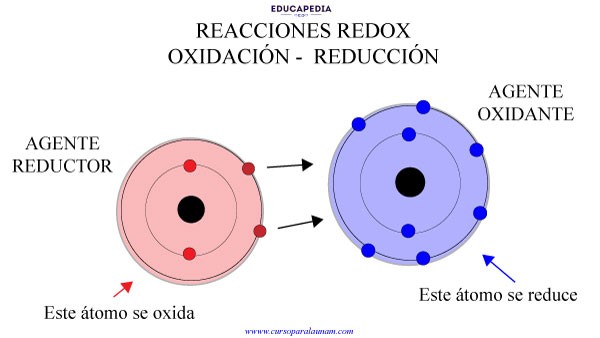
AGENTE OXIDANTE Y AGENTE REDUCTOR
Al elemento que pierde electrones se le llama Agente Reductor, porque hace que gane electrones el otro elemento (reduce al otro elemento)
Al elemento que gana electrones se le llama agente oxidante porque hace que pierda electrones el otro elemento (oxida al otro elemento).
Si un elemento, en una reacción Redox “pierde electrones”, se dice que se oxida, pero hace que el otro elemento que recibió esos electrones se reduzca, porque le hace ganar esos electrones.
¡Recuerda!
En el fenómeno cotidiano de que un metal se oxida, el oxígeno del aire, es el agente oxidante, porque hace que el metal “pierda” electrones.
Pero el metal que se oxidó, es un agente reductor, porque hizo que el oxígeno ganara sus electrones, es decir, el oxígeno se redujo.
¡PEQUEÑA CONFUSIÓN!
Cuando un elemento se oxida, suena como si hubiera “ganado” algo, pero no. En realidad, perdió sus electrones.
Y cuando un elemento se reduce, suena perfectamente como si hubiera perdido algo, pero, al contrario, gano electrones.
Siempre ten en mente que el oxígeno, tienen 8 electrones, 2 en el 1er nivel y 6 en el 2do nivel, por lo que anda buscando completar sus 8 electrones del 2do nivel, robando electrones por todos lados.
Mas ejemplos, ejercicios y preguntas clave de examen, en nuestras guías digitales.
-
 Guía UNAM Área 4 2023Producto rebajado$450.00
Guía UNAM Área 4 2023Producto rebajado$450.00 -
 Guía UNAM Área 3 2023Producto rebajado$450.00
Guía UNAM Área 3 2023Producto rebajado$450.00 -
 Guía UNAM Área 2 2023Producto rebajado$450.00
Guía UNAM Área 2 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 4-2023$80.00
Guía UNAM de Química Área 4-2023$80.00 -
 Guía UNAM de Química Área 3-2023$80.00
Guía UNAM de Química Área 3-2023$80.00 -
 Guía UNAM de Química Área 2-2023$90.00
Guía UNAM de Química Área 2-2023$90.00 -
 Guía UNAM Área 1 2023Producto rebajado$450.00
Guía UNAM Área 1 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 1-2023$80.00
Guía UNAM de Química Área 1-2023$80.00



