CÁLCULO DE LA MASA MOLAR
¡Ojo!
NO confundir la Masa “molar” con la Masa “molecular”.
La masa molecular es la masa de una sola molécula, y se obtiene simplemente sumando los pesos atómicos de cada elemento que participa en el compuesto.
Por ejemplo, el agua es H2O, el peso atómico del Hidrogeno es 1, y del Oxigeno es 16, por lo tanto, la masa molecular del agua es 18 UMA, es decir 2 UMA por los 2 átomos de hidrogeno y 16 UMA por el átomo de Oxígeno.
CONCEPTOS INICIALES
DISOLUCIÓN
La disolución es la mezcla o unión de un disolvente con un soluto.
PUREZA
La pureza es la relación que hay entre el soluto y la disolución, y se expresa en porcentaje.
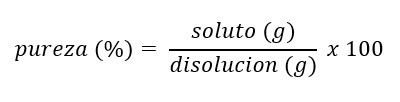
DENSIDAD
La densidad es la relación de la cantidad de materia entre el volumen. En disoluciones es igual a masa de la disolución entre el volumen en litros de la misma disolución.
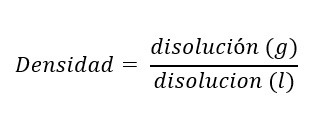
MOLARIDAD
La molaridad es igual al numero de moles entre la cantidad de disolución en litros.
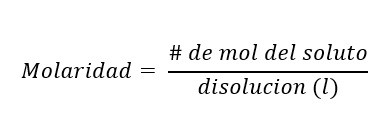
MASA MOLAR
La masa molar es la masa de un mol de algún compuesto.
¡OJO!
De un mol.
Es decir, de 6.022 x 1023 elementos (átomos o moléculas)
Gracias a que ya definimos las unidades que vamos a usar (UMA y MOL) ahora ya podemos pesar estas cantidades.
MÉTODO PARA CALCULAR LA MASA MOLAR
1.- Primero consideramos lo siguiente
a) 1 UMA es igual al peso de un protón o de un neutrón
b) 1 gramo es igual al peso de una MOL de protones o de neutrones
Si pesamos un mol de un elemento que tenga 2 protones, entonces este mol pesara 2 gramos.
Si pesamos un mol de un elemento más grande como el oxígeno que tienen 8 protones y 8 neutrones, entonces este mol pesará 16 gramos.
Si pesamos un mol de agua (H2O), primero tenemos que ver cuántos protones o neutrones tienen cada elemento.
El hidrogeno tiene solo 1 protón por lo tanto su masa atómica es 1 UMA
El oxígeno tiene 8 protones y 8 neutrones, por lo tanto, su masa atómica es 16 UMA.
Así que 2 moles de hidrógeno pesarán 2 gramos, más 1 mol de oxígeno (16 gramos) tendremos:
La masa molar de un mol de agua (H2O), es igual a 18 gramos.
Ya calculamos la masa en gramos de cierto número de MOL de sustancia. Ahora a la inversa, calcularemos cuantos MOL hay en ciertos gramos de sustancia.
CÁLCULO DEL NUMERO DE MOLES EN CIERTA MASA DE SUSTANCIA
Para calcula el número de moles que hay en cierta sustancia, solo se tiene que aplicar la regla de 3 o regla de las proporciones.
Por ejemplo, ¿en 50 gramos de agua, cuantos MOL hay?
1.- Como ya sabemos que una MOL de agua pesa 18 gramos.
Dividimos 50/18 = 2.7
Entonces en 50 gramos de agua hay 2.7 moles.
En términos de número de elementos
Si cada mol tiene 6.022 x 1023 moléculas, entonces hay 2.7 x 6.022x 1023 = 16.25 x 1023 moléculas.
Mas ejemplos, ejercicios y preguntas clave de examen, en nuestras guías digitales.
-
 Guía UNAM Área 4 2023Producto rebajado$450.00
Guía UNAM Área 4 2023Producto rebajado$450.00 -
 Guía UNAM Área 3 2023Producto rebajado$450.00
Guía UNAM Área 3 2023Producto rebajado$450.00 -
 Guía UNAM Área 2 2023Producto rebajado$450.00
Guía UNAM Área 2 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 4-2023$80.00
Guía UNAM de Química Área 4-2023$80.00 -
 Guía UNAM de Química Área 3-2023$80.00
Guía UNAM de Química Área 3-2023$80.00 -
 Guía UNAM de Química Área 2-2023$90.00
Guía UNAM de Química Área 2-2023$90.00 -
 Guía UNAM Área 1 2023Producto rebajado$450.00
Guía UNAM Área 1 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 1-2023$80.00
Guía UNAM de Química Área 1-2023$80.00