CLASIFICACIÓN DE ELEMENTOS: METALES, NO METALES Y METALOIDES
La última clasificación que podemos hacer en la tabla periódica es metales, no metales y metaloides. La cual se presenta como en la siguiente figura.
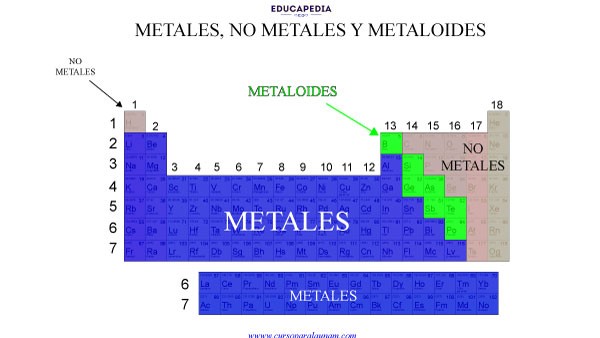
CARACTERÍSTICAS Y PROPIEDADES DE LOS METALES
1.- Los metales generalmente son sólidos y brillantes, altamente conductores de calor y electricidad, que forman aleaciones unos con otros y compuestos iónicos similares a sales con compuestos no metálicos —siempre que NO sean los gases nobles.
2.- Los metales tienden a perder electrones cuando se combinan con los No metales.
3.- Dentro de los Metales se subcategorizan, en metales alcalinos (altamente reactivos), metales alcalino-térreos (menos reactivos), lantánidos y actínidos, y metales de transición
CARACTERÍSTICAS Y PROPIEDADES DE LOS NO METALES
1.- Los No metales, la mayoría son gases incoloros o de colores que pueden formar enlaces covalentes con otros elementos no metálicos.
2.- Los No metales tienden a ganar electrones cuando se combinan con los metales.
3.- Aquí se encuentran los NO metales poli atómicos, los NO metales diatómicos y los NO metales monoatómicos que son los gases nobles (casi completamente inertes o que no se combinan con ningún otro elemento).
CARACTERÍSTICAS Y PROPIEDADES DE LOS METALOIDES
Entre metales y no metales están los metaloides, que tienen propiedades intermedias o mixtas.
¡Recuerda!
La tabla periódica está organizada de manera general por la configuración de los electrones de cada elemento.
Los elementos del lado izquierdo (metales) tienen una configuración electrónica que facilita que pierdan electrones, es decir, sus capas superiores tienen menos de la mitad del octeto de Lewis y por tanto es más fácil perder esos electrones que ganar otros.
Los elementos del lado derecho tienen más de la mitad de su octeto de Lewis y es más fácil que adquieran electrones de otros átomos y completen el octeto.
Mas ejemplos y preguntas de examen en nuestras guías digitales.
PROCEDIMIENTO GENERAL PARA DETERMINAR LA UBICACIÓN DE UN ELEMENTO EN LA TABLA PERIÓDICA
Determinar la ubicación de un elemento químico en la tabla periódica es algo parecido a determinar la ubicación de un punto (x, y) en el plano coordenado. Es decir, nos proporcionan un código o lo calculamos y después determinamos su ubicación en la tabla periódica.
PASO 1
El dato o código que nos ayudara a determinar la ubicación de un elemento es su configuración electrónica más externa.
El código es algo parecido a esto:
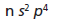
Y con lo que hemos aprendido acerca de la organización de la tabla periódica determinaremos su ubicación.
PASO 2
Si no tienes la configuración electrónica del elemento a ubicar, tienes que desarrollarla tú mismo. Te proporcionaran entonces el elemento y con el diagrama de Moeller determinar su configuración electrónica.

PASO 3
Una vez que tengas la configuración electrónica del elemento determina:
EL PERIODO
El ultimo nivel de energía localiza el periodo
EL GRUPO
PARA LOS DEL GRUPO “A”
a) Si el ultimo subnivel es “s” o “p” pertenecen al grupo “A” y para determinar el número exacto de la columna:
Se suman los electrones que tiene su ultimo subnivel “s” o sus dos últimos subniveles “s” y “p”.
Ejemplo:

PARA LOS ELEMENTOS DEL GRUPO “B”
b) Si el ultimo subnivel es “d” entonces es del grupo B y para determinar el número exacto de la columna:
Se suman los electrones de sus últimos subniveles “d” y “s”:
a) Si la suma es 3, 4, 5, 6 o 7 el grupo es IIIB, IVB, VB, VIB, VIIB respectivamente.
b) Si la suma es 8, 9 o 10 el grupo es VIIIB (1ra, 2da y 3ra columna respectivamente).
c) Y si la suma es 11 o 12 el grupo es IB y IIB respectivamente.
Ejemplos:

PARA LOS ELEMENTOS DEL GRUPO “C”
c) y si termina en un subnivel “f” es un elemento de transición interna:
Para determinar su periodo determinamos el nivel energético de su ultimo electrón, que puede ser 6 o 7.
Y todos pertenecen al grupo IIIB.
Ejemplos:
1.- Localiza la ubicación en la Tabla Periódica del elemento con Z = 35.
Primero recuerda que Z es el número atómico de los elementos. Es decir, el número de protones que tiene. Y como los elementos que están en la tabla periódica son neutros, es decir, tiene el mismo número de protones que de electrones, este elemento tiene 35 electrones.
Segundo, determinamos su configuración electrónica de estos 35 electrones.
Tercero:
Este elemento está en el 4to periodo (renglones horizontales) porque su ultimo electrón está en el 4to nivel energético
Si sumamos los electrones de su última capa tenemos que:
Por lo que pertenece al grupo o familia VIIA.
Mas ejemplos, ejercicios y preguntas clave de examen, en nuestras guías digitales.
-
 Guía UNAM Área 4 2023Producto rebajado$450.00
Guía UNAM Área 4 2023Producto rebajado$450.00 -
 Guía UNAM Área 3 2023Producto rebajado$450.00
Guía UNAM Área 3 2023Producto rebajado$450.00 -
 Guía UNAM Área 2 2023Producto rebajado$450.00
Guía UNAM Área 2 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 4-2023$80.00
Guía UNAM de Química Área 4-2023$80.00 -
 Guía UNAM de Química Área 3-2023$80.00
Guía UNAM de Química Área 3-2023$80.00 -
 Guía UNAM de Química Área 2-2023$90.00
Guía UNAM de Química Área 2-2023$90.00 -
 Guía UNAM Área 1 2023Producto rebajado$450.00
Guía UNAM Área 1 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 1-2023$80.00
Guía UNAM de Química Área 1-2023$80.00





