CLASIFICACIÓN DE LOS ACIDOS Y BASES POR SU CONDUCTIVIDAD: FUERTES Y DÉBILES
¡Recuerda!
La ionización es el proceso cuando una sustancia o una molécula se separa en diferentes partes cargadas eléctricamente (iones), unas partes estarán cargadas positivamente (cationes) y otras negativamente (aniones).
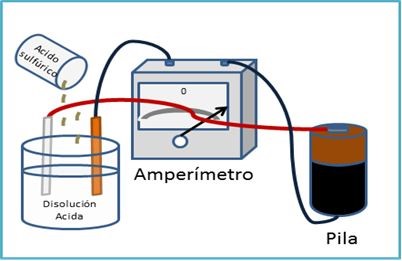
Como ya vimos en las teorías sobre ácidos y bases, son iones los que se mueven de aquí para allá. Así que además de poder medir las concentraciones de estos iones con el pH, podemos medir la capacidad con que conducen electricidad.
CLASIFICACIÓN DE LOS ÁCIDOS Y BASES POR SU CONDUCTIVIDAD:
ÁCIDOS
Los ácidos fuertes son electrolitos que se ionizan completamente en el agua y debido a esto son buenos conductores de la electricidad, es decir, tienen alta conductividad.
Los ácidos débiles se ionizan solo en forma parcial en el agua y por esto son malos conductores de la electricidad, es decir, tienen poca conductividad.
BASES
Las bases fuertes son electrolitos que se ionizan completamente en el agua y por lo tanto, también son buenos conductores de electricidad.
Las bases débiles solo se ionizan en forma parcial por lo que tienen baja conductividad.
CONCLUSIÓN
Los ácidos y las bases fuertes son fuertes porque cuando se mezclan en agua, estos ácidos y bases se ionizan completamente, lo que hace que la solución sea una buena conductora de electricidad.
Los ácidos y las bases débiles son débiles, porque cuando se mezclan en agua se ionizan muy poco, por lo que hace que la solución tenga poca capacidad de conducir la electricidad.
Mas ejemplos, ejercicios y preguntas clave de examen, en nuestras guías digitales.
-
 Guía UNAM Área 4 2023Producto rebajado$450.00
Guía UNAM Área 4 2023Producto rebajado$450.00 -
 Guía UNAM Área 3 2023Producto rebajado$450.00
Guía UNAM Área 3 2023Producto rebajado$450.00 -
 Guía UNAM Área 2 2023Producto rebajado$450.00
Guía UNAM Área 2 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 4-2023$80.00
Guía UNAM de Química Área 4-2023$80.00 -
 Guía UNAM de Química Área 3-2023$80.00
Guía UNAM de Química Área 3-2023$80.00 -
 Guía UNAM de Química Área 2-2023$90.00
Guía UNAM de Química Área 2-2023$90.00 -
 Guía UNAM Área 1 2023Producto rebajado$450.00
Guía UNAM Área 1 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 1-2023$80.00
Guía UNAM de Química Área 1-2023$80.00



