TEORÍAS ÁCIDOS-BASE: ARRHENIUS, BRÖNSTED-LOWRY Y LEWIS
Existen 3 teorías que tratan de describir químicamente a los ácidos y a las bases. Estas teorías que se sucedieron temporalmente son:
1.- La teoría de Arrhenius
2.- La teoría de Brönsted-Lowry
3.- La teoría de Lewis
LA TEORÍA DE ARRHENIUS
La teoría de Arrhenius fue desarrollada a finales del siglo XIX y define a los ácidos y a las bases de la siguiente forma:
ÁCIDOS
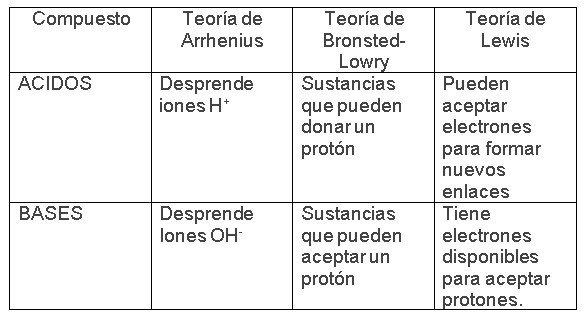
Los ácidos son “sustancias que cuando se disuelven en agua se forman cationes hidrogeno (H+).
Ejemplo de un ácido de Arrhenius:
El cloruro de hidrogeno es un ácido de Arrhenius porque cuando se disuelve en agua produce iones H+ y Cl– hidratados.
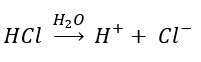
BASES
Las Bases según Arrhenius son sustancias que cuando se disuelven en agua se forman iones hidroxilo (-OH)
Ejemplo de una base de Arrhenius:
El hidróxido de sodio es una base de Arrhenius debido a que el NaOH cuando se disuelve en agua se disocia en iones Na+ y OH–
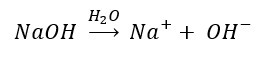
¡Recuerda!
La teoría de Arrhenius sobre los ácidos y bases es:
Los ácidos liberan iones H+
Las bases liberan iones OH–
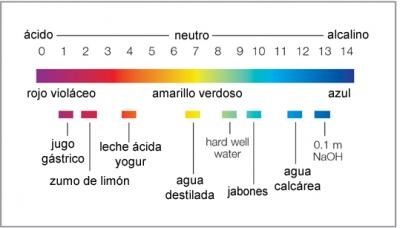
MEDICIÓN DE LA ACIDEZ O BASICIDAD
La acidez o basicidad de una disolución acuosa se mide por medio de la concentración relativa del (H3O+) y del OH−.
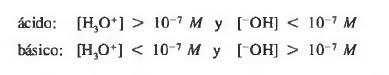
Debido a que estas concentraciones pueden abarcar un amplio rango de valores, la acidez o basicidad de una disolución se miden en una escala logarítmica.
DEFINICIÓN DE PH
El pH se define como el logaritmo negativo (base 10) de la concentración de (H3O+)
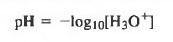
Una disolución neutra tiene un pH de 7
Una disolución acida tiene un pH menor a 7
Una disolución básica tiene un pH mayor a 7.
¡Ojo!
El logaritmo negativo invierte el orden que estábamos manejando, es decir, a mayor concentración de iones positivos (H3O+), mayor acidez, pero en el pH, a mayor acidez más bajo su pH.
También en esta teoría de Arrhenius, se forma una sal y agua a partir de la reacción entre un ácido y una base.
En otras palabras, cuando reaccionan un ácido y una base, llamada reacción de neutralización, como resultado obtenemos una sal y agua.
ácido+ + base− → sal + agua
Los iones positivos procedentes de una base forman una sal con los iones negativos procedentes de un ácido.
LA TEORÍA BRÖNSTED-LOWRY
La teoría de Brönsted-Lowry define a los ácidos y bases sobre el fenómeno de la transferencia de protones.
En esta teoría:
ACIDO
Un ácido es cualquier sustancia que puede donar un protón.
BASE
Una base es cualquier sustancia que puede aceptar un protón.
¡Comparando esta teoría con la de Arrhenius, tenemos que!
Los ácidos de Arrhenius que son compuestos que liberan iones H+ son los ácidos de Bronsted-Lowry que son donadores de protones (H+).
Recuerda que el hidrogeno solo tiene un protón y un electrón, por lo tanto, si pierde su electrón solo queda un protón, llamado también ion hidrogeno (H+).
Las bases de Arrhenius que son compuestos que liberan iones OH– son las bases de Bronsted-Lowry porque estos iones OH– son aceptadores de protones, pero las bases de Brosted-Lowry no se limita a iones OH–, sino que pueden ser cualquier compuesto que pueda aceptar protones (H+).
También otra diferencia entre la teoría de Arrhenius, es que Arrhenius considera a los ácidos y las bases cuando se diluían en agua, y la teoría de Brosted-Lowry no se limita a estas reacciones, sino que pueden ser cualquier compuesto y el que done los protones es un acido y el que los acepte es una base.
LA TEORÍA DE LEWIS
Esta teoría aprovecha el concepto del Octeto del mismo Lewis, por lo que:
Según esta teoría:
ACIDO
Un ácido es aquel que puede aceptar en forma compartida un par de electrones
BASE
Una base es aquella que puede compartir o donar un par de electrones no compartidos.
¡Ojo!
La teoría de Lewis habla acerca de la transferencia de electrones, no de protones.
COMPARACIÓN GENERAL ENTRE LAS DIFERENTES TEORÍAS
Ejemplos:
1.-Utilizando la teoría de Arrhenius determina qué tipo de sustancia (acido, base o sal) son los siguientes compuestos cuando se disuelven en agua:

Mas ejemplos, ejercicios y preguntas clave de examen, en nuestras guías digitales.
-
 Guía UNAM Área 4 2023Producto rebajado$450.00
Guía UNAM Área 4 2023Producto rebajado$450.00 -
 Guía UNAM Área 3 2023Producto rebajado$450.00
Guía UNAM Área 3 2023Producto rebajado$450.00 -
 Guía UNAM Área 2 2023Producto rebajado$450.00
Guía UNAM Área 2 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 4-2023$80.00
Guía UNAM de Química Área 4-2023$80.00 -
 Guía UNAM de Química Área 3-2023$80.00
Guía UNAM de Química Área 3-2023$80.00 -
 Guía UNAM de Química Área 2-2023$90.00
Guía UNAM de Química Área 2-2023$90.00 -
 Guía UNAM Área 1 2023Producto rebajado$450.00
Guía UNAM Área 1 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 1-2023$80.00
Guía UNAM de Química Área 1-2023$80.00




como se puede citar este articulo?
Gracias! un excelente apoyo.