ESTRUCTURA ATÓMICA
Los modelos atómicos es el conjunto de modelos que se han sucedido para explicar de mejor manera la estructura interna de la materia.
DEFINICIÓN DE MODELO
Un modelo es un conjunto de ideas que tratan de explicar un fenómeno.
No es necesario ver directamente el fenómeno, si el modelo pueda explicarlo y predecir sus manifestaciones, este modelo será considerado válido hasta que no pueda explicar otras manifestaciones de este mismo fenómeno.
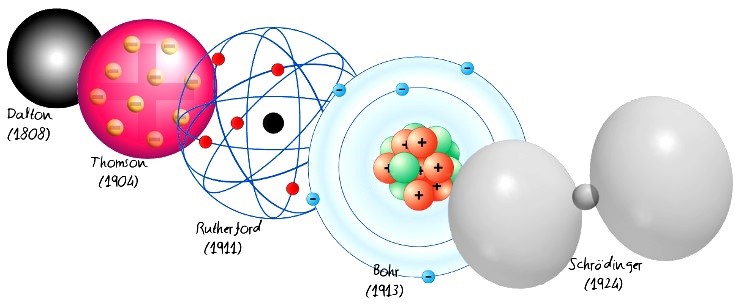
1er MODELO ATÓMICO
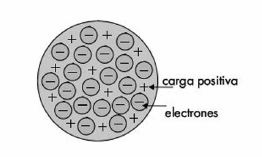
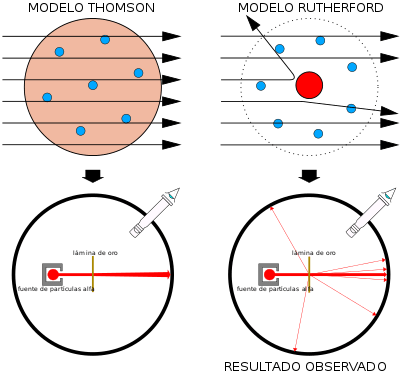
MODELO ATÓMICO DE THOMPSON O MODELO DEL BUDÍN DE PASAS
Uno de los primeros modelos sobre el átomo fue propuesto por J.J. Thomson en el año 1897 que propone lo siguiente:
El átomo es un tipo de esfera que contiene cargas positivas distribuidas en su superficie (a manera de pasas) y las cargas negativas están incrustadas dentro de la esfera distribuidas en capas.
Después de este modelo, Rutherford (alumno de Thomson) propone su propio modelo:
2do MODELO ATÓMICO
MODELO ATÓMICO DE RUTHERFORD
Rutherford, gracias a los conocimientos de Thomson y a su famoso experimento, propone que:
“El átomo tiene un núcleo donde se concentra su masa y donde está su carga positiva y alrededor de este núcleo se encuentran los electrones con carga negativa”

3er MODELO ATÓMICO
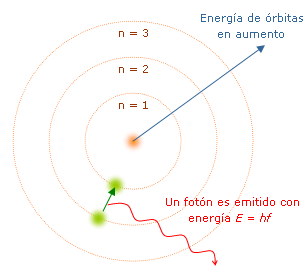
MODELO ATÓMICO DE BOHR
En 1913 el físico Niels Bohr para tratar de explicar porque los electrones no colapsaban con el núcleo continua básicamente con el modelo de Rutherford, pero agrega que:
“Los electrones además de girar alrededor del núcleo solo lo pueden hacer en determinados niveles de energía, donde el nivel menor de energía es el más cercano al núcleo”
Con este modelo además de tratar de explicar las separaciones de electrones con el núcleo, también trataba de explicar porque algunos átomos emitían radiaciones de diferentes frecuencias (fotones que salen expulsados cuando el electrón cambia de un nivel energético a otro).
EL EXPERIMENTO DE RUTHERFORD
Rutherford que había propuesto que la masa del electrón se concentraba en el núcleo con carga positiva y los electrones alrededor de este núcleo, se basó en su famoso experimento que consistió en términos simples en:
Lanzar un haz de partículas alfa a una lámina delgada metálica y ver qué sucede con las partículas alfa que rebotan en esta lamina.
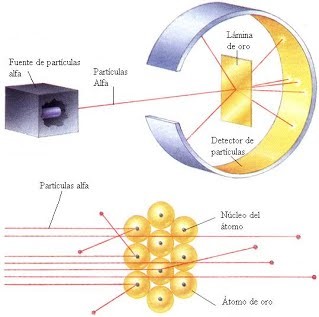
Rutherford encontró que la mayoría de estas partículas alfa podían traspasar la lámina y que otra pequeña fracción rebotan como si algo pequeño lo hubiese impedido.
Como sabía que los rayos que incidían tenían cargas positivas, llego a la conclusión que lo que no permitía el traspaso de estos rayos era un núcleo en el centro de los átomos cargado positivamente.
Mas ejemplos, ejercicios y preguntas clave de examen, en nuestras guías digitales.
-
 Guía UNAM Área 4 2023Producto rebajado$450.00
Guía UNAM Área 4 2023Producto rebajado$450.00 -
 Guía UNAM Área 3 2023Producto rebajado$450.00
Guía UNAM Área 3 2023Producto rebajado$450.00 -
 Guía UNAM Área 2 2023Producto rebajado$450.00
Guía UNAM Área 2 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 4-2023$80.00
Guía UNAM de Química Área 4-2023$80.00 -
 Guía UNAM de Química Área 3-2023$80.00
Guía UNAM de Química Área 3-2023$80.00 -
 Guía UNAM de Química Área 2-2023$90.00
Guía UNAM de Química Área 2-2023$90.00 -
 Guía UNAM Área 1 2023Producto rebajado$450.00
Guía UNAM Área 1 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 1-2023$80.00
Guía UNAM de Química Área 1-2023$80.00



Los comentarios están cerrados.