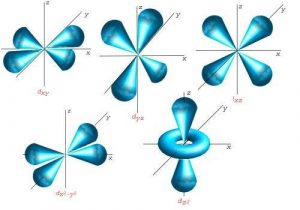
ORBITALES ATÓMICOS
CONCEPTOS INICIALES DE LOS ORBITALES ATÓMICOS
UN POCO DE HISTORIA
Al estudiar los átomos, debido a la imposibilidad de verlos directamente, uno de los fenómenos que nos ayudan a entenderlos es su emisión de energía. Es decir, los átomos emiten energía. Y cuando se estaba estudiando esto, se dieron cuenta que esta emisión no es una emisión continua. No tenía todos los valores de un rango de energía, sino que solo tenía algunos valores. Gracias a este fenómeno se inició el descubrimiento de que los electrones del átomo solo podían estar en ciertas zonas alrededor del núcleo a las que se les llamo niveles de energía.
Este concepto de niveles de energía ha ido evolucionado de orbitas atómicas a orbitales atómicos.
ORBITAS ATÓMICAS
Las orbitas atómicas vienen del modelo inicial de Niels Bohr, que consideraba a los electrones girando alrededor del núcleo en orbitas circulares definidas.
ORBITALES ATÓMICOS
Los orbitales atómicos son zonas del espacio con una alta probabilidad de encontrar un electrón.
¡Recuerda!
Aunque en las figuras anteriores se pueden apreciar figuras definidas, en realidad se trata de regiones de probabilidades.
PUNTO DE QUIEBRE
La diferencia entre orbitas y orbitales atómicos está en dos descubrimientos de la mecánica cuántica a principios del siglo XX.
1.- No se puede conocer con exactitud la posición de las partículas subatómicas (Principio de incertidumbre de Heinsenberg)
2.- Las partículas subatómicas tienes propiedades de partículas, pero también de onda (lo cual fue expresado con las ecuaciones de Schrödinger)
DEFINICIÓN MATEMÁTICA DE LOS ORBITALES ATÓMICOS
Un poco más complicado, pero más exacto, es que los orbitales atómicos son regiones del espacio definidas para una solución particular de la ecuación de Schrödinger.
Esta zona queda definida por la ecuación de Schrödinger, de la cual se extraen los números cuánticos, que delimitan las soluciones a esta ecuación, es decir delimitan las áreas más probables donde se localiza el electrón
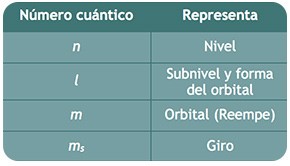
LOS NÚMEROS CUÁNTICOS
Los números cuánticos son valores numéricos que sirven para describir el lugar y la energía que ocupan los electrones alrededor del núcleo, es decir, para describir los orbitales atómicos.
Algunos autores consideran 3 números cuánticos (n, l, y m) y el spin del electrón (ms) aparte.
De forma más exacta:
Los números cuánticos son los valores numéricos que delimitan las soluciones a la ecuación de Schrödinger, que es la ecuación que define el área donde es más probable se encuentren los electrones y son: “n”, “l”, “m” y “s”.
De forma general los numero cuánticos representa los siguientes conceptos físicos en el átomo:
n: NUMERO CUÁNTICO PRINCIPAL
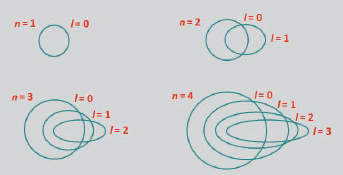
El numero cuántico “n” o principal indica el tamaño del orbital o su cercanía al núcleo.
Con n=1 para la capa más cercana al núcleo y la de menor energía.
Conforme se alejan las capas del núcleo, estas adquieren mayor energía y pueden albergar más electrones.
El número cuántico principal “n” también indica el número de subniveles que hay en cada nivel de energía.
Por ejemplo; en el n=1, hay 1 subnivel, en n=2 hay dos subniveles y así sucesivamente. A estos subniveles se les define como “l: número secundario o azimutal”.
L: numero Cuántico Secundario O Azimutal
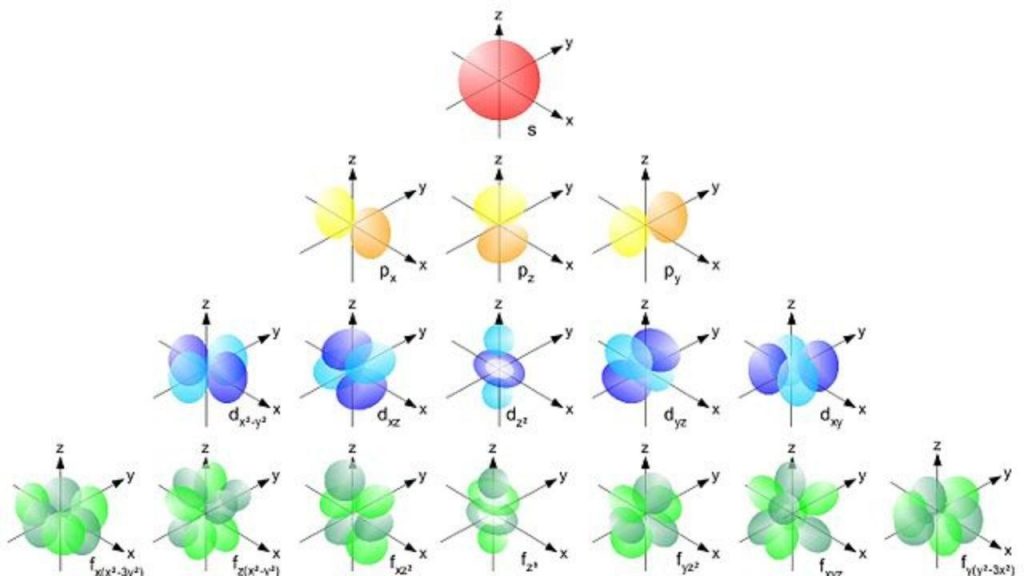
El numero cuántico “l”, también llamado: secundario, azimutal, número cuántico del momento angular orbital o número cuántico de la forma del orbital es el número que describe la forma geométrica del orbital.
Los valores que puede obtener el número cuántico “l” son:
L = 0 = “s”
L = 1 = “p”
L = 2 = “d”
L = 3 = “f”
L = 4 = “g”, Etc.
¡Ojo!
El valor de “n” es numéricamente igual al número de subniveles “l”. Es decir:
Si n = 1 entonces l = 0 = s y solo tiene 1 subnivel “s”.
Si n = 4 entonces tendrá 4 subniveles, s, p, d, f.
Si n = 6 entonces tendrá 6 subniveles, s, p, d, f, g, h.
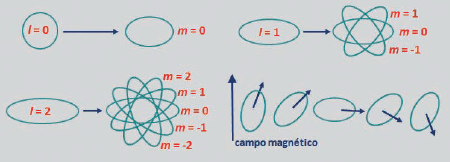
m: NUMERO CUÁNTICO MAGNÉTICO O LA ORIENTACIÓN ESPACIAL DEL ORBITAL
El número cuántico “m”, también llamado: número cuántico magnético o número cuántico de la orientación espacial del orbital indica precisamente la orientación espacial del orbital y puede adquirir valores desde –L hasta +L.
Así, si L = 2, m puede valer -2, -1, 0, +1 y +2, lo que significa que el subnivel d, se desdobla en otros 5.
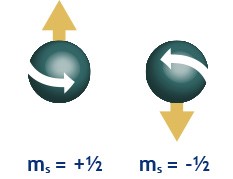
s: NUMERO CUÁNTICO DEL SPIN DEL ELECTRÓN O MOMENTO ANGULAR DEL GIRO DEL ELECTRÓN.
Una partícula eléctrica como el electrón que gira, crea un campo magnético, tal y como sucede en todos los fenómenos electromagnéticos. Por tanto, el electrón, en su giro crea un campo magnético, que puede tener dos orientaciones, una en sentido a las manecillas del reloj y otro en sentido contrario.
El número cuántico s o espín del electrón, es el número que indica la orientación en la que gura el electro sobre su propio eje.
El número cuántico s o espín del electro puede tener valores de -1/2 y +1/2.
RESUMEN DE LOS NÚMEROS CUÁNTICOS

FORMAS DE LOS SUBORBITALES s, p, d y f.
Ejemplos:
1.- Determina si los siguientes números cuánticos pueden ser posibles:
a) (0, 0, 0, +1/2)
b) (2, 2, 1, 0)
c) (3, 1, 2, -1/2)
Respuestas:
a) El número cuántico nunca puede tener un valor de 0.
b) El número cuántico l no puede tener el mismo valor que n y el spin del electrón solo puede valer -1/2 o +1/2
c) El valor numérico de m no puede ser mayor que l.
Mas ejemplos, ejercicios y preguntas clave de examen, en nuestras guías digitales.
-
 Guía UNAM Área 4 2023Producto rebajado$450.00
Guía UNAM Área 4 2023Producto rebajado$450.00 -
 Guía UNAM Área 3 2023Producto rebajado$450.00
Guía UNAM Área 3 2023Producto rebajado$450.00 -
 Guía UNAM Área 2 2023Producto rebajado$450.00
Guía UNAM Área 2 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 4-2023$80.00
Guía UNAM de Química Área 4-2023$80.00 -
 Guía UNAM de Química Área 3-2023$80.00
Guía UNAM de Química Área 3-2023$80.00 -
 Guía UNAM de Química Área 2-2023$90.00
Guía UNAM de Química Área 2-2023$90.00 -
 Guía UNAM Área 1 2023Producto rebajado$450.00
Guía UNAM Área 1 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 1-2023$80.00
Guía UNAM de Química Área 1-2023$80.00