TABLA PERIÓDICA
DEFINICIÓN DE TABLA PERIÓDICA
La tabla Periódica de los elementos es un arreglo espacial donde se acomodan los elementos químicos de acuerdo a su “Número Atómico”, y de manera que las propiedades periódicas como el tamaño atómico, el potencial de ionización, la afinidad electrónica, la electronegatividad, el punto de fusión y el de ebullición, queden agrupadas.
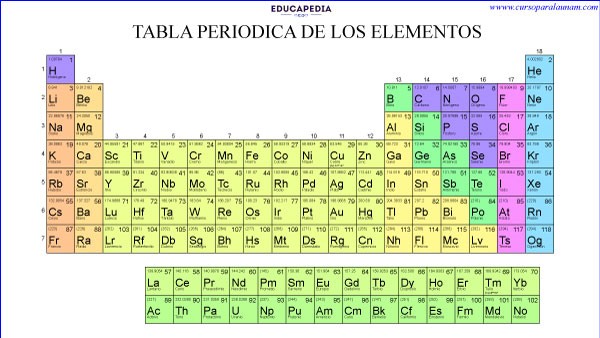
ORGANIZACIÓN PRINCIPAL DE LA TABLA PERIÓDICA
La tabla periódica está organizada principalmente por líneas horizontales llamadas “periodos” y líneas verticales llamadas “grupos o familias”.
Con 7 periodos horizontales, 18 grupos verticales.
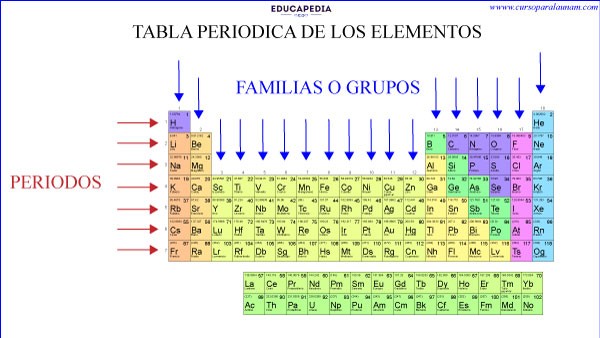
LOS PERIODOS
Los periodos o las hileras horizontales indican los niveles de energía o número cuántico “n”, hasta donde llega su ultimo electrón. Entre más electrones tenga un elemento, su ultimo electrón alcanzara niveles más altos.
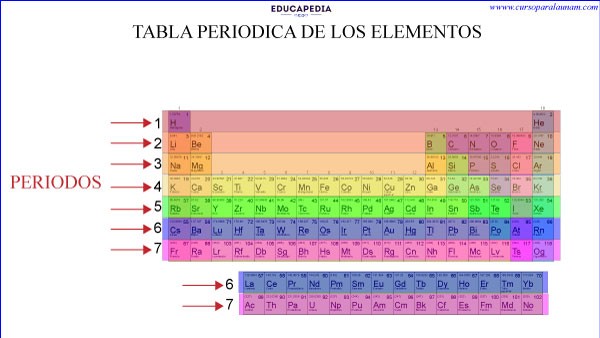
Ejemplos de periodos de la tabla periodica:
1.- El primer periodo solo tiene dos elementos (H y He) porque su ultimo electrón solo llega hasta 1s.
2.- El segundo periodo tiene 8 elementos, porque el ultimo electrón de estos elementos solo llega a 2s o 2p.
3.- El tercer periodo tiene también 8 elementos. ¿Por qué si 3er nivel energético le caben 18 electrones?
Porque según la secuencia de la configuración electrónica, no la forma, la secuencia, antes de que acomodemos electrones en el 3d, acomodamos electrones en el 4s, por lo que ya se consideran del 4 periodo.
Así que los elementos que pertenecen al 3er periodo, solo son los que llegan sus electrones al 3s y 3p. Pero no al 3d. Porque, repito, antes de llenar el 3d, empezamos a llenar el 4s.
GRUPOS O FAMILIAS
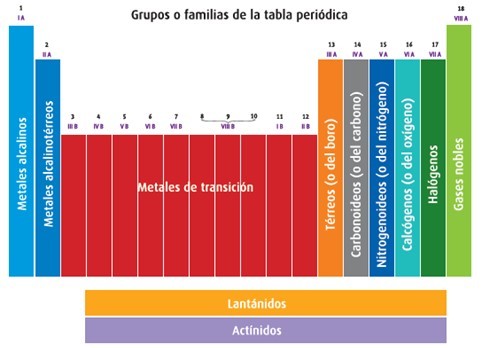
Las columnas verticales se les llama “Grupos o Familias” y la tabla contienes 18 columnas, es decir, 18 grupos o familias.
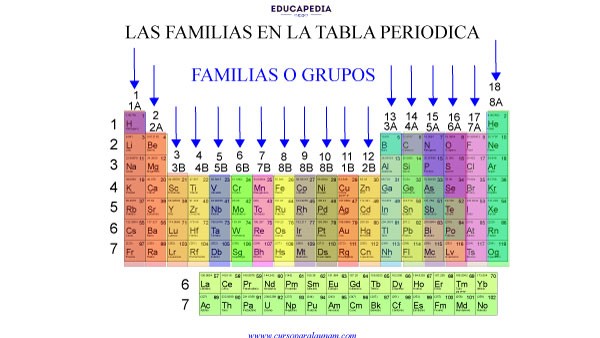
¡Ojo!
Existen dos formas de clasificar estas columnas verticales. La clasificación con letras (A y B) y la clasificación de la IUPAC numeradas del 1 al 18. (Ya casi no se ocupa con letras)
LA CARACTERÍSTICA MAS IMPORTANTE DE LAS FAMILIAS
La característica más importante de los grupos o familias es que tienen la misma configuración de la capa más externa de sus electrones y el número de familia coincide con el número de electrones más externos.
Esto, te va a ayudar a ubicar elementos químicos si te dan su configuración electrónica.
Es decir:
La familia 1 (IA) todos tienen 1 electrón en su último orbital s.
La familia 2 (IIA) todos tienen 2 electrones en su último orbital s.
La familia 3 (3B) todos tienen 3 electrones en sus últimos 2 orbitales (d y s)
Ejemplos de familia de la tabla periodica:
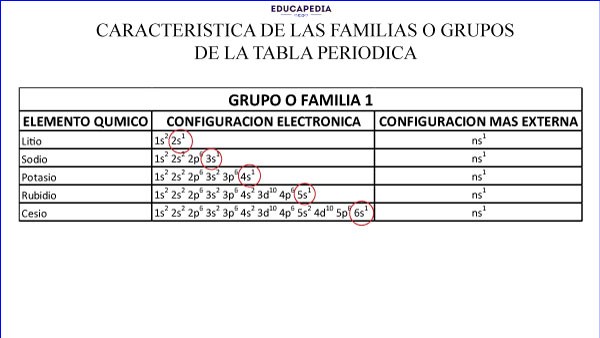
Mas ejemplos y preguntas de examen en nuestras guías digitales.
Gracias a esta última configuración se puede hacer un tipo de clasificación química de los elementos como: los metales, los no metales y los metales de transición.
OTRAS CARACTERÍSTICAS QUE COMPARTEN LOS GRUPOS O FAMILIAS DE LA TABLA PERIÓDICA
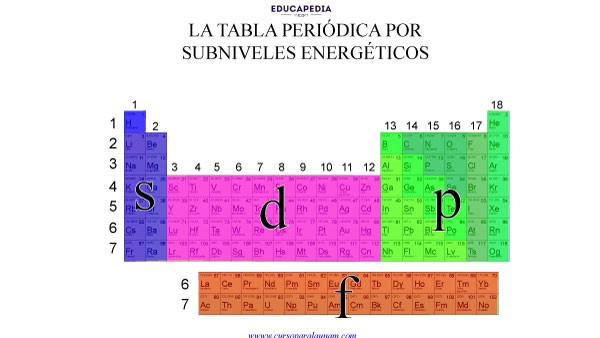
Tienen sus últimos electrones en el mismo subnivel o en el mismo número cuántico “l”, es decir:
Las familias o grupos 1(IA) y 2 (IIA), los Metales Alcalinos y los metales Alcalino-Térreos tienen su ultimo electrón en el subnivel “s”
Todos los metales de Transición (de la familia 3 a la12, o de la IB a la VIIIB) tienen sus últimos electrones en el subnivel “d”.
Y todos los NO Metales: (Metaloides y Gases Nobles) excepto el Helio (su único electrón lo tiene en el subnivel “s”) tienen sus últimos electrones en el subnivel “p”.
Por último, los lantánidos y actínidos, tienen sus últimos electrones en el subnivel “f”.
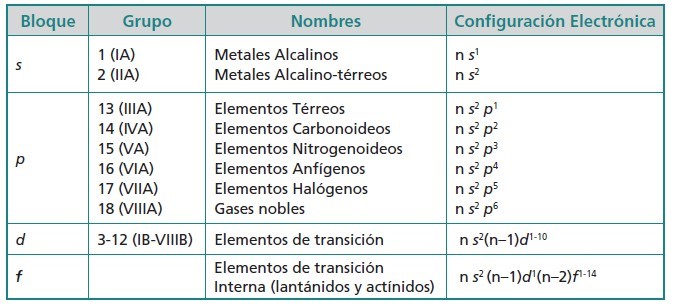
TIPOS DE ELEMENTOS QUÍMICOS
Los bloques que hemos identificado que pertenecen a un subnivel energético forman grupos o bloques más o menos idénticos a su subnivel energético llamados: Los elementos representativos, los elementos de transición, los elementos de transición interna y los gases nobles.
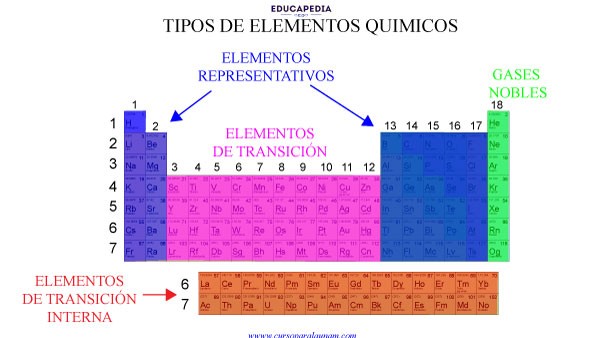
ELEMENTOS REPRESENTATIVOS O PRINCIPALES
CARACTERÍSTICAS GENERALES DE LOS ELEMENTOS REPRESENTATIVOS
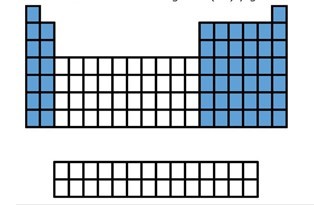
A los elementos representativos (las 2 primeras columnas y las ultimas 6), se les acostumbra asignar con numero romano y la letra A o son los de las columnas enumeradas; 1, 2, y del 13 al 17.
Estos elementos son los que tienen su ultimo electrón en el subnivel “s” o “p”.
El bloque “s” agrupa los elementos de los grupos 1 y 2 (los alcalinos y los alcalinotérreos)
El bloque “p”, los grupos 13,14,15,16, el 17 (los halógenos) y el 18 (los gases nobles).
¡Ojo!
Aunque los gases nobles también tienen su ultimo electrón en un subnivel “p”, debido a sus características especiales se les considera por separado.
CARACTERÍSTICAS DE LOS ELEMENTOS ALCALINOS Y ALCALINOTÉRREOS (GRUPO 1 Y 2)
¡Ojo!
Todos los elementos de los grupos 1 y 2, “excepto el Hidrogeno” son metales.
CARACTERÍSTICAS DE LOS METALES ALCALINOS
1.- Todos los metales alcalinos (grupo 1 o IA) son metales blandos, plateados y muy reactivos
2.- Estos metales son excelentes conductores térmicos y eléctricos
3.- Estos metales tienen baja energía de ionización debido a que su ultimo electrón se puede eliminar con mucha facilidad.
CARACTERÍSTICAS DE LOS METALES ALCALINOTÉRREOS
1.- Todos los metales alcalinotérreos (grupo 2 o IIA) son blancos plateados, maleables, dúctiles y un poco más duros que los metales alcalinos.
2.- Cada elemento tiene 2 electrones en su nivel más externo.
3.- Estos metales tienen un estado de oxidación +2.
4.- Los metales alcalinotérreos no son tan reactivos como los alcalinos
ELEMENTOS DE TRANSICIÓN
Características de los elementos de transición:
1.- El ultimo electrón de estos elementos está en el subnivel “d”.
2.- Todos son metales, también llamados metales de transición.
3.- Son mas duros y quebradizos que los elementos representativos.
4.- Tienen sus puntos de ebullición, vaporización y fusión mas altos que los demás elementos de la tabla.
5.- Las sustancias donde se forman iones de estos metales suelen tener color.
6.- La mayoría de estos elementos tiene mas de un estado de oxidación diferente de cero.
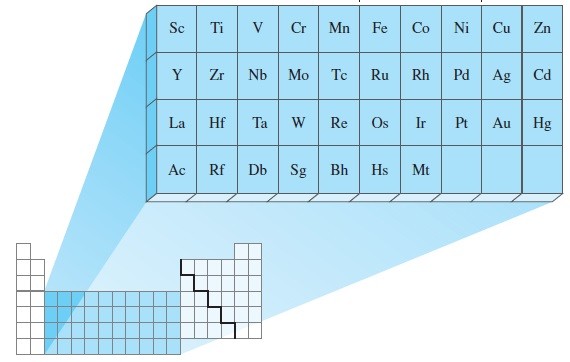
ELEMENTOS DE TRANSICIÓN INTERNA
Características de los elementos de transición interna:
El ultimo electrón de estos elementos está en el subnivel “f”.
Comprenden 2 series de 14 elementos; los lantánidos (forman parte del periodo 6) y los actínidos (forman parte del periodo 7)
GASES NOBLES
Características de los gases nobles:
1.- Presentan siempre los subniveles ns y np completamente llenos de electrones (excepto el Helio), es decir, tienen 8 electrones en su última capa por lo que tienen una terminación en su configuración electrónica ns2 np6.
2.- Los gases nobles hierven a temperatura muy baja.
3.- Los gases nobles son incoloros, inodoros e insípidos.
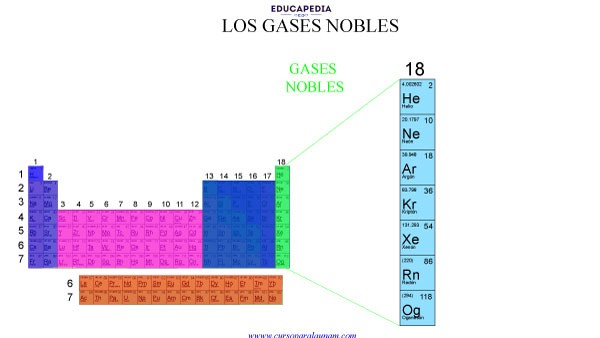
RESUMEN DE TIPOS DE ELEMENTOS DE LA TABLA PERIÓDICA
Ejemplos de organización de la tabla periódica:
1.- ¿Cuál es la caracteriza electrónica que diferencia a los gases nobles de los elementos representativos?
La diferencia está en que los gases nobles además de que su ultimo electrón está en el subnivel “s” o “p”, su última capa siempre tiene 8 electrones (excepto el helio) y están llenando los subniveles “s” y “p”.
Gracias a estos últimos 8 electrones que llenan estos subniveles, tienen gran estabilidad a su configuración electrónica y dificulta las interacciones con otros átomos, incluso con los de su mismo tipo.
IDENTIFICAR LOS ELEMENTOS POR SU SÍMBOLO QUÍMICO
La mayoría de los elementos químicos tienen un símbolo que concuerdan con las letras iniciales de su nombre. Como, por ejemplo: Hidrogeno (H), Oxigeno (O), Neón (Ne), etc.
Gracias a esto es fácil recordar el nombre de muchos elementos.
Sin embargo, existen otros elementos que tienen un nombre en inglés u otra lengua y símbolo no concuerda.
Los más importantes que pueden causar confusión son:
1.- Sodio (Na)
2.- Fosforo (P)
3.- Azufre (S)
4.- Potasio (K)
5.- Hierro (Fe)
6.- Cobre (Cu)
7.- Plata (Ag)
8.- Oro (Au)
9.- Mercurio (Hg)
Mas ejemplos, ejercicios y preguntas clave de examen, en nuestras guías digitales.
-
 Guía UNAM Área 4 2023Producto rebajado$450.00
Guía UNAM Área 4 2023Producto rebajado$450.00 -
 Guía UNAM Área 3 2023Producto rebajado$450.00
Guía UNAM Área 3 2023Producto rebajado$450.00 -
 Guía UNAM Área 2 2023Producto rebajado$450.00
Guía UNAM Área 2 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 4-2023$80.00
Guía UNAM de Química Área 4-2023$80.00 -
 Guía UNAM de Química Área 3-2023$80.00
Guía UNAM de Química Área 3-2023$80.00 -
 Guía UNAM de Química Área 2-2023$90.00
Guía UNAM de Química Área 2-2023$90.00 -
 Guía UNAM Área 1 2023Producto rebajado$450.00
Guía UNAM Área 1 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 1-2023$80.00
Guía UNAM de Química Área 1-2023$80.00





