TEMPERATURA SEGÚN LA TEORÍA CINÉTICA DE LOS GASES
TEORÍA CINÉTICA DE LOS GASES
La teoría cinética de los gases es una teoría física que explica el comportamiento macroscópico de los gases, como su presión y temperatura, en base al conjunto de los comportamientos de las moléculas de las que está constituido dicho gas.
Es decir, la teoría cinética de los gases considera que el comportamiento promedio de todas las moléculas del gas forma cierta propiedad macroscópica de dicho gas.
POSTULADOS DE LA TEORÍA CINÉTICA DE LOS GASES
Los postulados sobre los que se basa la teoría cinética de los gases son:
1.- Los gases como un conjunto de partículas sólidas, puntuales y que obedecen a las leyes de Newton
2.- El número de partículas es muy grande y su separación entre ellas también es muy grande con respecto al tamaño individual de cada una de ellas.
3.- Las partículas se mueven de forma aleatoria en líneas rectas.
4.- Los choques que se dan entre estas partículas son elásticos por lo que se conserva el momento lineal y la energía cinética de cada una de ellas.
5.- Todas las moléculas son idénticas
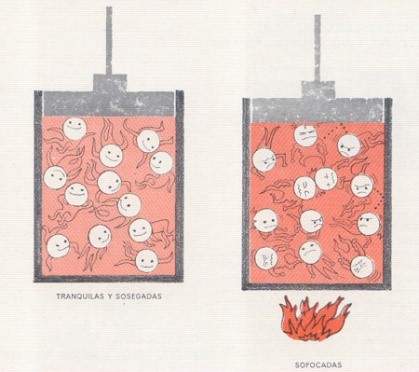
LA TEMPERATURA
Según la teoría cinética de los gases:
La Temperatura de una sustancia es la medida de las energías cinéticas promedio de todas sus moléculas.
Como recordaras, la energía cinética está en función de la velocidad de los cuerpos, por lo que también podríamos decir que:
La temperatura es una medida de las velocidades promedio de las partículas de las moléculas de un gas.
Es decir, cuando tocas algo “caliente”, lo que sientes es un conjunto de moléculas que chocan contra tu piel a una velocidad más alta que la velocidad con la que vibran las moléculas de tu piel, y si tocas algo frio lo que sientes es un conjunto de moléculas que vibran a una velocidad más baja que con la que vibran las moléculas de tu piel.
Mas ejemplos, ejercicios y preguntas clave de examen, en nuestras guías digitales.
-
 Guía UNAM Área 4 2023Producto rebajado$450.00
Guía UNAM Área 4 2023Producto rebajado$450.00 -
 Guía UNAM Área 3 2023Producto rebajado$450.00
Guía UNAM Área 3 2023Producto rebajado$450.00 -
 Guía UNAM Área 2 2023Producto rebajado$450.00
Guía UNAM Área 2 2023Producto rebajado$450.00 -
 Guía UNAM de Física Área 4-2023$90.00
Guía UNAM de Física Área 4-2023$90.00 -
 Guía UNAM de Física Área 3-2023$90.00
Guía UNAM de Física Área 3-2023$90.00 -
 Guía UNAM de Física Área 2-2023$90.00
Guía UNAM de Física Área 2-2023$90.00 -
 Guía UNAM Área 1 2023Producto rebajado$450.00
Guía UNAM Área 1 2023Producto rebajado$450.00 -
 Guía UNAM de Física Área 1-2023$90.00
Guía UNAM de Física Área 1-2023$90.00





