CONFIGURACIONES ELECTRÓNICAS
DEFINICIÓN DE CONFIGURACIÓN ELECTRÓNICA
Una configuración electrónica es la manera en que se distribuyen los electrones alrededor el núcleo
Esta manera la podemos dividir en dos partes: La forma y la secuencia.
La forma es como si se tratara de un ropero donde tenemos que acomodar nuestra ropa, los cajones de abajo y los espacios de arriba.
La secuencia es el orden de como iremos metiendo nuestra ropa al ropero.
Primero los calcetines en los cajones de abajo, después las camisas en los espacios de arriba.
¡Ojo!
Es muy importante esta distinción entre forma y secuencia, porque cuando acomodamos nuestra ropa en el ropero, lo más lógico sería ir llenando lo cajones de abajo para arriba, pero en el átomo a veces en lo que estamos guardando los calcetines en un cajón se nos aparece una camisa que metemos en la parte de arriba y luego seguimos llenando el cajón de los calcetines.
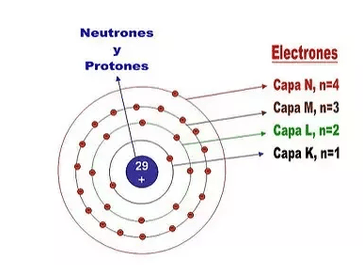
FORMA DE LA CONFIGURACIÓN ELECTRÓNICA
Ahora que ya conocemos los conceptos básicos de los números cuánticos podemos decir de forma general y para simplificar que:
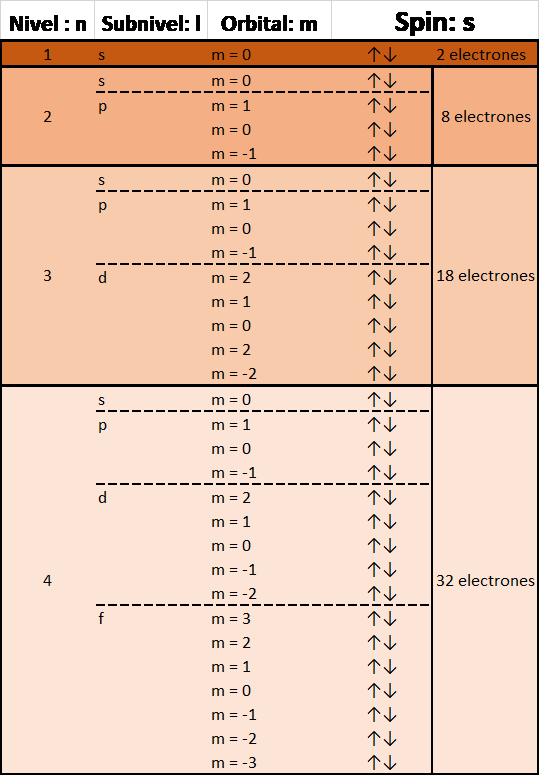
Cada nivel energético, representado por el número cuántico “n”, le van “apareciendo” sucesivamente subniveles representados por el número cuántico “l” y que toman valores simbólicos como “s, p, d, f…”
Es decir, el 1er nivel (n = 1) tiene 1 subnivel (l = 0 = s), el 2do nivel (n = 2) tiene dos subniveles, (l = 0 (s) y l = 1 (p)) y así sucesivamente.
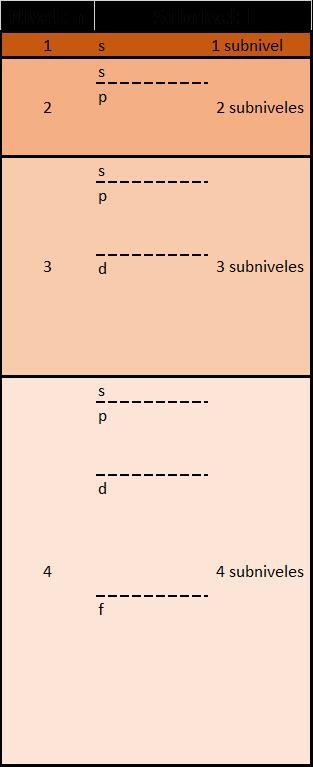
Después, cada subnivel “l” tiene un número posible de orientaciones (s tiene 1 orientación posible, p tiene 3 orientaciones posibles y así sucesivamente) representadas por el numero cuántico “m”.
Ahora con estos datos concluimos que:
“El número total de “tipos” de orbitales posibles en cada nivel energético es igual a n2”.
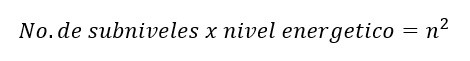
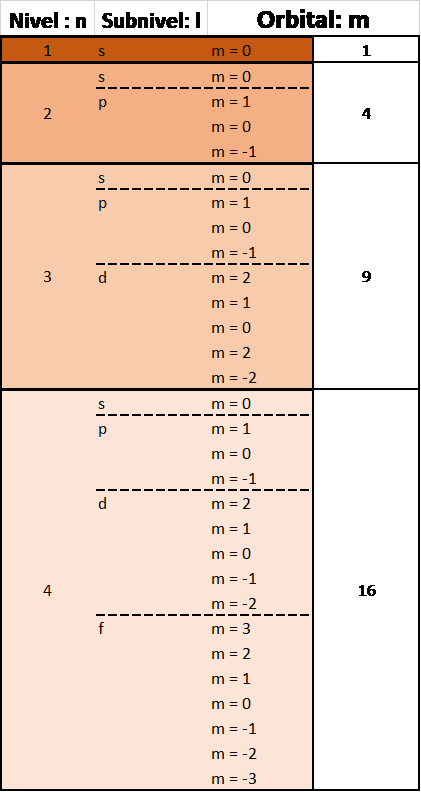
Por último, a cada orbital le podemos colocar 2 electrones con diferente orientación magnética (-1/2, +1/2) representados por el numero cuántico “ms”.
Por lo que para saber el número total de electrones posibles por nivel energético podemos aplicar la fórmula:
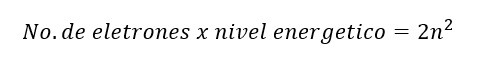
SECUENCIA DE LA CONFIGURACIÓN ELECTRÓNICA
Ahora que ya conocemos como está configurado nuestro espacio alrededor del núcleo donde iremos metiendo los electrones, vamos a ver el orden de esta secuencia.
Este orden se debe a 3 principios:
1.- El Principio de la Mínima Energía
2.- EL Principio de Exclusión de Pauli
3.- La Regla de la Máxima Multiplicidad de Hund
LOS 3 PRINCIPIOS DE LA CONFIGURACIÓN ELECTRÓNICA:
1.-PRINCIPIO DE LA MÍNIMA ENERGÍA
También conocida como principio de la mínima energía establece que la configuración electrónica de un átomo se consigue colocando una a uno cada electrón en sus orbitales de menor a mayor energía.
¡Ojo!
Aunque los orbitales están ordenados de menor a mayor energía, el acomodo de los electrones no sigue esta secuencia lineal, depende de los dos principios siguientes.
2.-PRINCIPIO DE EXCLUSIÓN DE PAULI
Este principio establece que ningún electrón puede tener los mismos valores de sus 4 números cuánticos (n, l, m, s), por lo tanto, si hay 2 electrones en un mismo tipo de orbital (l) electrónico de cierta orientación (ml), estos deben tener diferente número cuántico “s” (1/2 o -1/2) lo que indica que tienen espines opuestos.
Lo que determina lo que ya habíamos mencionado: Que en un tipo de orbital (l) con cierta orientación (ml) solo puede haber 2 electrones con spines opuestos.
3.-REGLA DE LA MÁXIMA MULTIPLICIDAD DE HUND
Esta regla indica que en una capa con varios orbitales de la misma energía se van llenando de electrones distribuyéndolos en cada órbita de la misma energía con los spines paralelos.
Una vez que se han distribuidos uno a uno en cada orbital de la misma energía, ahora ya se pueden colocar de forma apareada, es decir en el mismo orbital, pero con spin opuesto.
Con esto se cumple que, cuando se van distribuyendo los electrones, sea la configuración de mínima energía, y como los electrones se repelen, por eso lo primero es distribuirlos lo más separadamente posible.
REGLAS PARA IR LLENANDO LOS ORBITALES (SECUENCIA DE LLENADO DE ELECTRONES)
Las siguientes reglas o formas para ir llenando los orbitales de electrones nos ayudan a lograr este “llenado” de electrones respetando los 3 principios de la configuración electrónica:
PRINCIPIO DE MADELUNG
El principio de Madelung nos expresa que:
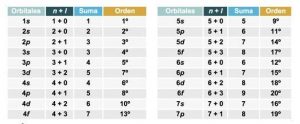
La energía de un subnivel es directamente proporcional a la suma de los números cuánticos “n” y “l”.
Si hay dos subniveles con el mismo valor (n + l), tiene menor energía el que tenga el valor “n” menor.
Ejemplos:
Para el orbital 3d, tenemos que n = 3 y l = 2 lo que nos da “n + l = 5”
Para el orbital 4s, tenemos que n = 4 y l = 0 lo que nos da “n + l = 4”
Lo que nos indica que el subnivel 4s tiene una energía menor que el subnivel 3d, lo que quiere decir, que tenemos que llenar primero 4s antes que 3d.
Mas ejemplos y preguntas de examen en nuestras guías digitales.
PRINCIPIO DE EDIFICACIÓN PROGRESIVA O REGLA DE AUFBAU
Esta regla también llamada “Principio de la Mínima Energía” como el principio que vimos anteriormente, es un tipo de método que resumen los 3 principios de la configuración electrónica y que también utiliza el Diagrama de Moeller.
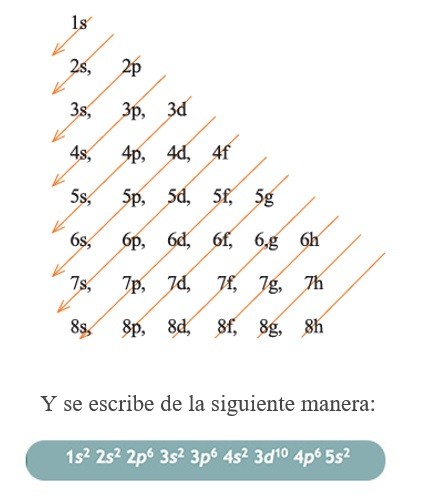
Este principio establece que los subniveles energéticos se irán llenando conforme se van llenando primero los niveles más bajos de energía. Lo cual podemos conseguir siguiendo el orden del Diagrama de Moeller.
DIAGRAMA DE MOELLER
¡DEFINICIÓN EXTRA!
Cuando esta distribución es la de más baja energía se le llama “Distribución Electrónica Fundamental”.
Ejemplos:
1.- Determina los 4 números cuánticos de un electrón que está en 2s.
Primero tenemos que está en el nivel energético n = 2.
Después como esta en el suborbital s entonces l = 0
Como todos los suborbitales tiene una sola orientación tenemos que ml = 0.
Y por último el electrón puede tener cualquiera de los spines ms = +-1/2
Mas ejemplos, ejercicios y preguntas clave de examen, en nuestras guías digitales.
-
 Guía UNAM Área 4 2023Producto rebajado$450.00
Guía UNAM Área 4 2023Producto rebajado$450.00 -
 Guía UNAM Área 3 2023Producto rebajado$450.00
Guía UNAM Área 3 2023Producto rebajado$450.00 -
 Guía UNAM Área 2 2023Producto rebajado$450.00
Guía UNAM Área 2 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 4-2023$80.00
Guía UNAM de Química Área 4-2023$80.00 -
 Guía UNAM de Química Área 3-2023$80.00
Guía UNAM de Química Área 3-2023$80.00 -
 Guía UNAM de Química Área 2-2023$90.00
Guía UNAM de Química Área 2-2023$90.00 -
 Guía UNAM Área 1 2023Producto rebajado$450.00
Guía UNAM Área 1 2023Producto rebajado$450.00 -
 Guía UNAM de Química Área 1-2023$80.00
Guía UNAM de Química Área 1-2023$80.00





